
| A. | ③④ | B. | ①②③④ | C. | ①③④ | D. | 全部 |
分析 ①碳酸氢钠溶液与氢氧化钠反应生成碳酸钠和水;
②氧化铝为两性氧化物,与氢氧化钠反应生成偏铝酸钠和水;
③氢氧化铝为两性物质,能够与氢氧化钠反应生成偏铝酸钠和水;
④铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
⑤硅与氢氧化钠反应生成硅酸钠和氢气.
解答 解:①碳酸氢钠溶液与氢氧化钠反应生成碳酸钠和水,故①选;
②氧化铝为两性氧化物,与氢氧化钠反应生成偏铝酸钠和水,故②选;
③氢氧化铝为两性物质,能够与氢氧化钠反应生成偏铝酸钠和水,故③选;
④铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,故④选;
⑤硅与氢氧化钠反应生成硅酸钠和氢气,故⑤选;
故选:D.
点评 本题主要考查元素及化合物性质,熟悉相关物质的化学性质是解题关键,注意两性物质的概念及性质,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
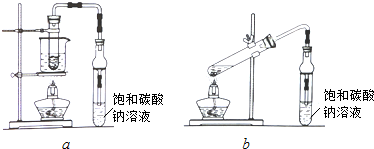
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:2 | B. | 3:2:2 | C. | 2:5:2 | D. | 1:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和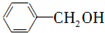 两种物质的试剂是a.
两种物质的试剂是a.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 副族元素中没有非金属元素 | |
| B. | 碱金属元素是指ⅠA族的所有元素 | |
| C. | 除第1周期外,其他周期均有18种元素 | |
| D. | 7个横行代表7个周期,18个纵行代表18个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 6.72 L | B. | 8.98 L | C. | 11.56 L | D. | 13.44 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com