
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
| ⑨ | ⑩ |
| 1 |
| 2 |
| 1 |
| 8 |
| m |
| V |
4×
| ||
| 4.70×10-23 |
| 4×63.6 |
| 9.00×4.70×10-23 |
| 4×63.6 |
| 9.00×4.70×10-23 |


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
A、化合物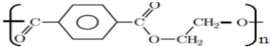 名称为聚对苯甲二酸乙二酯 名称为聚对苯甲二酸乙二酯 |
| B、C3H7OH与C4H9OH分子间脱水,最多可生成6种醚 |
C、1mol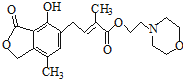 最多可与含4mol NaOH的水溶液完全反应 最多可与含4mol NaOH的水溶液完全反应 |
D、某油脂的化学式为 ,它属于酯类但不属于高分子化合物 ,它属于酯类但不属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
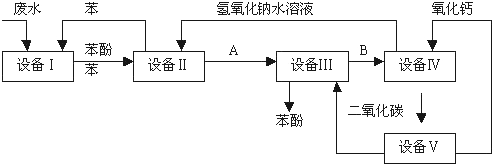
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
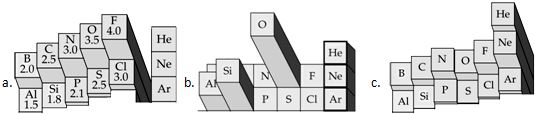
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2杂质 |
| B、用渗析的方法除去NaCl溶液中含有的少量淀粉胶体 |
| C、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| D、用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com