
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。如图是元素周期表的一部分,表中所列序号①、②、③、④、⑤、⑥、⑦、⑧分别代表某种化学元素。根据表格所给信息,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ⑤ | ⑥ | ⑦ | ④ | ⑧ | |||
(1)8种元素中,性质最稳定的是___(填元素符号)。
(2)①与④可形成___化合物(填“共价”、“离子”),其电子式为___。
(3)原子半径②___③,①___⑤(填“>”、“<”或“=”)。
(4)在元素⑤、⑥、⑦中,金属性最强的元素是___。(填元素符号)。
【答案】Ar 共价 ![]() > < Na
> < Na
【解析】
依据元素在周期表中的位置,可确定①为H,②为C,③为O,④为Cl,⑤为Na,⑥为Mg,⑦为Al,⑧为Ar。
(1)8种元素中,原子最外层达到稳定结构时,性质最稳定,所以性质最稳定的元素是Ar。答案为:Ar;
(2) ①为H,④为Cl,①与④可形成HCl,两种非金属原子间形成共价键,为共价化合物,其电子式为![]() 。答案为:共价;
。答案为:共价;![]() ;
;
(3)②为C,③为O,二者为同周期元素,O在C的右边,所以原子半径C>O;①为H,⑤为Na,Na与H同主族,且Na比H多了2个电子层,所以原子半径H<Na。答案为:>;<;
(4) ⑤为Na,⑥为Mg,⑦为Al,三种金属为同周期元素,从左往右,金属性依次减弱,所以金属性最强的元素是Na。答案为:Na。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】某同学设计实验探究工业制乙烯的原理和乙烯主要的化学性质,实验装置如图所示。
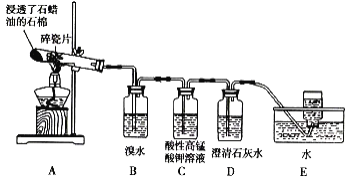
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热、加压条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷可发生如下反应,反应式已配平:C16H34![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为______;乙的结构简式为____。
4乙,则甲的分子式为______;乙的结构简式为____。
(2)B装置中的实验现象是______。
(3)C装置中的实验现象是_____,其中发生反应的反应类型是___。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_(填序号)中的实验现象可判断该资料是否真实。
(5)通过题述实验探究可知,检验甲烷和乙烯的方法是_____(填序号,下同);除去甲烷中乙烯的方法是____。
A.气体通入水中 B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
(6)分别燃烧乙烯和甲烷,乙烯产生黑烟,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,HCN溶液中CN-和HCN浓度所占分数(α)随pH变化的关系如图所示,下列表述正确的是( )
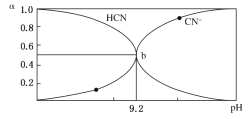
A.Ka(HCN)的数量级为10-9
B.0.1mol/LHCN溶液使甲基橙试液显红色
C.1L物质的量都是0.1mol的HCN和NaCN混合溶液中c(HCN)>c(CN-)
D.0.1mol/LNaCN溶液的pH=9.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.硫酸铜溶液中加过量的氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
B.用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+=Ca2++CO2↑+H2O
C.将去膜的铝片投入到NaOH溶液中:2Al+2OH—+6H2O=2[Al(OH)4]— +3H2↑
D.用碘化钾淀粉溶液检验亚硝酸钠中NO2-的存在:NO2-+2I-+2H+=NO↑+I2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成乳酸(![]() )的一种途径如下:
)的一种途径如下:
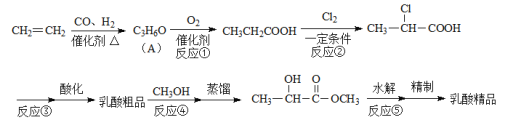
完成下列填空:
(1)乳酸中的官能团名称是__________________。A的结构简式是_____________________。
(2)反应②的反应类型是____________________。反应③的条件是_____________________。
(3)反应④的化学方程式为_______________________________________________________。
(4)聚乳酸是一种常用的可降解塑料,由乳酸聚合得到,其结构如下:
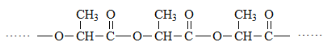
聚乳酸降解时,会产生自催化效应(降解的速度会越来越快),请解释原因。___________________________________________________________。
(5)设计一条由丙烯制备丙酸的合成路线。________________________(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g) ![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。

下列有关说法正确的是
A. 一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234 kJ热量
B. 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C. 若X表示温度,则Y表示的可能是CO2的物质的量浓度
D. 若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]= 1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. HCOO-的水解常数为1.0×10-10。
B. Zn(OH)2溶于水形成的饱和溶液中,c(Zn2+)>1.0×10-6mol·L-1
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2(s)+2HCOOH(aq)![]() Zn2+(aq) +2HCOO-(aq)+2H2O(1)的平衡常数K=100
Zn2+(aq) +2HCOO-(aq)+2H2O(1)的平衡常数K=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能作为高效清洁的二次能源,应用前景日益广泛。二甲醚制氢技术是实现小规模现场制氢的一种理想方案。其反应原理主要分两步:
二甲醚水解:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) ΔH1=+23.53kJ/mol 反应Ⅰ
2CH3OH(g) ΔH1=+23.53kJ/mol 反应Ⅰ
甲醇与水蒸汽重整:CH3OH(g)+H2O(g) ![]() 3H2(g)+CO2(g) ΔH2=+49.48kJ/mol 反应Ⅱ
3H2(g)+CO2(g) ΔH2=+49.48kJ/mol 反应Ⅱ
回答下列问题。
(1)反应CH3OCH3(g)+3H2O(g) ![]() 6H2(g)+2CO2(g) ΔH3=_________。该反应自发进行的条件是___________(填“高温”、“低温”或“任意条件”)。
6H2(g)+2CO2(g) ΔH3=_________。该反应自发进行的条件是___________(填“高温”、“低温”或“任意条件”)。
(2)实验室条件下,二甲醚与水蒸汽以物质的量之比1:3混合,以固定的高流速通过填充有催化剂HZSM-5(分子筛)反应器。测得如下关系图(图1和图2)。图2中的平衡值是指不同温度下的平衡转化率。
已知:二甲醛转化率=![]()
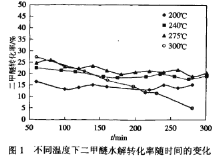
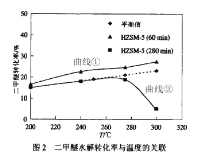
①下列说法合理的是__________
A.图1中表明,催化剂HZSM-5的活性只受温度影响,与反应持续时间无关
B.图1中使用不同的催化剂可以改变二甲醚水解的平衡转化率
C.图2中曲线①数值高于平衡值,是因为催化剂可能会吸附部分未反应的二甲醚
D.图2中曲线①和曲线②在275℃前二甲醚的转化率与平衡转化率的趋势一致,这与反应I和反应II是吸热反应有关
E.图2中曲线②在在较低温度时二甲醚的转化率与平衡值保持一致,主要是反应持续280min后已达到平衡状态
②图2曲线②数值在280℃之后明显下降,解释可能原因___________
(3)在固定体积容器内,二甲醚与水蒸汽以物质的量之比1:3投料,温度恒定为150℃,二甲醚的平衡转化率约为15%,平衡时容器内总压为P0,升温到280℃并保持恒定,再次达到平衡,此时二甲醚平衡转化率接近22%,而容器内总压约为1.5P0,请解释升温二甲醚平衡转化率增大的原因。__________________
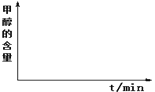
(4)研究表明,在相同条件下,反应Ⅰ的活化能远小于反应Ⅱ的活化能,在固定体积容器内,二甲醚与水蒸汽以物质的量之比1:3投料,温度恒定为250℃,反应在t1时刻达到平衡,在图中作出甲醇含量随时间变化的关系图____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+、B+、C-、D、E五种粒子(分子或离子)中,每个粒子均有10个电子,已知:
①A++C-![]() D+E↑;②B++C-===2D。
D+E↑;②B++C-===2D。
请回答:
(1)C-离子的电子式是________________。
(2)A+离子中的键角为______________。
(3)分别写出A+和D反应、B+和E反应的离子方程式____________、____________。
(4)除D、E外,请再写出两种含10个电子的分子的分子式____________。
(5)除A+、B+外,请再写出两种含10个电子的阳离子________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com