
2Mn2++O2+4OH- ![]() 2MnO(OH)2(反应快)
2MnO(OH)2(反应快)
MnO(OH)2+2I-+4H+ ![]() Mn2++I2+3H2O
Mn2++I2+3H2O
I2+2![]()
![]() 2I-+
2I-+![]()
(1)水中溶解O2的量(以mg·L-1为单位)为多少?
(2)I2和![]() 反应以淀粉为指示剂,达到终点时溶液的颜色如何变化?
反应以淀粉为指示剂,达到终点时溶液的颜色如何变化?
(3)加MnSO4及含NaOH的KI溶液后振荡时,若塞子未塞紧(设振荡时未溅出溶液),测定结果与(1)中的计算结果相比有差别吗?为什么?
(4)开塞到加H2SO4前的时间间隔很长,测定结果又如何?说明理由。
解析:这是一道信息给予题,已知量为Na2S2O3的物质的量,未知量为溶解在水中的O2的量,根据题给条件找出O2与Na2S2O3之间的量的关系是解答此题的关键,由题中三个离子方程式可得关系式:O2~4Na2S2O3,据此可进行计算。
(1)O2~4Na2S2O3
1mol 4mol
n(O2) V×10
![]()
![]()
因此水中溶解氧气的量为
![]()
(2)I2与![]() 反应以淀粉为指示剂,在含I2的溶液中加入淀粉后溶液变蓝色,这个过程是可逆的,向溶液中加入Na2S2O3溶液与I2发生反应,当I2刚好被消耗完后,溶液由蓝色变为无色。
反应以淀粉为指示剂,在含I2的溶液中加入淀粉后溶液变蓝色,这个过程是可逆的,向溶液中加入Na2S2O3溶液与I2发生反应,当I2刚好被消耗完后,溶液由蓝色变为无色。
(3)若塞子未塞紧,水中溶解的O2反应消耗完后,空气中的O2又会溶解,这样会引起测定结果的偏高。
(4)若开塞到加H2SO4前的时间间隔很长,由于溶解的O2消耗完后,空气中的O2也会溶解,从而导致测定结果偏高。
![]()
(2)向含淀粉的I2溶液中加入Na2S2O3溶液,达到终点时,溶液颜色由蓝色变为无色。
(3)偏高,空气中的O2溶解。
(4)偏高,空气中的O2溶解。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 6.830 | 13.660 | 30.000 |
| 二氧化硫气体的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.800 | 1.600 | 3.200 |
查看答案和解析>>
科目:高中化学 来源:黄冈重点作业 高一化学(下) 题型:038
环境监测测定水中含氧气的方法是:量取aml水样,迅速加入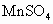 及含有NaOH的KI溶液,塞好塞子,振荡使反应均匀后,开塞,迅速加入硫酸,此时有碘生成,用浓度为bmol·
及含有NaOH的KI溶液,塞好塞子,振荡使反应均匀后,开塞,迅速加入硫酸,此时有碘生成,用浓度为bmol·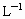 的
的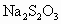 溶液和碘反应,消耗Vml(用淀粉作指示剂).上述过程的反应为:
溶液和碘反应,消耗Vml(用淀粉作指示剂).上述过程的反应为:
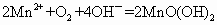
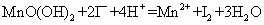
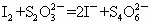
(1)水中溶解的氧气的量为多少?(用含a、b、V字母形式表示,单位mg/L)________
(2)以淀粉作指示剂,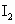 和
和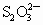 的反应达到反应终点时,溶液颜色变化情况是________.
的反应达到反应终点时,溶液颜色变化情况是________.
(3)开塞到加硫酸之间的间隔时间若过长,测得结果比实际值________(填“高”、“低”或“不变”),原因是________.
查看答案和解析>>
科目:高中化学 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:058
环境监测测定水中溶解氧的方法是:
(1)准确量取a mL水样,置于洁净干燥的带塞锥形瓶中,迅速加固剂MnSO2溶液和碱性KI溶液(含KOH),立即塞好塞子并振荡摇匀,使之充分反应:
2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)
(2)测定:开塞后迅速加入适量硫酸使锥形瓶内发生如下反应:
MnO(OH)2+2I-+4H+=Mn2++I2+2H2O
向锥形瓶中加入少许指示剂淀粉试液,用浓度为b mol/L的Na2S2O3溶液滴定到终点时共消耗V mL Na2S2O3溶液.其反应式为:I2+![]() =2I-+
=2I-+![]() 试回答:
试回答:
①准确量取a mL水样的仪器是________
②滴定到终点的判断依据是________
③水中溶解氧气的量(以克/升为单位)的计算式为________
④测定时,滴定管经水洗,蒸馏水洗后,加滴定剂Na2S2O3溶液,然后滴定,这样会导致测定结果________(填偏低、偏高、无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
环境监测测定水中溶解O2的方法是:量取aml水样于一个锥形瓶中,迅速往其中加入MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子,振荡使反应均匀.打开塞,迅速加入适量硫酸溶液,此时有I2生成.用硫代硫酸钠溶液(浓度为bmol/L)和I2反应(滴定),消耗了Vml(以淀粉指示剂).有关反应的方程式为:2Mn2++O2+4OH-=2MnO(OH)2(反应很快)
MnO(OH)2+2I-+4H+=Mn2++I2+3H2O
I2+2![]() =2I-+S4O2-6
=2I-+S4O2-6
(1)水中溶解O2的量(以mg/L为单位)为多少?
(2)I2和S2O2-3反应以淀粉为指示剂,达终点时溶液颜色如何变化?
(3)加MnSO4及含KI的NaOH溶液后,振荡时,若塞子未塞紧(设振荡时未溅出溶液),测定结果与塞紧塞子测定的结果相比如何?为什么?
(4)打开塞子到加硫酸溶液前的时间间隔很大,测定结果又如何?说明理由.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com