
化学基本概念的理解和把握是学好化学的关键。下列说法正确的是
A.燃烧热指的是可燃物完全燃烧生成稳定的氧化物所放出的热量
B.勒夏特列原理指的是,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动
C.盐溶液不一定显中性,不显中性的盐都会促进水的电离
D.电镀是利用原电池原理在某些金属表面镀上一薄层其他金属或合金的方法
科目:高中化学 来源:2014-2015宁夏回族自治区银川一中高二上学期期末考试化学试卷(解析版) 题型:选择题
25℃时pH=13的NaOH溶液与pH=2的H2SO4溶液混合,所得混合液的pH=11,则NaOH溶液与 H2SO4溶液的体积比是
A.1∶9 B.1∶11 C.9∶1 D.11∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015辽宁省大连市高二上学期期末考试化学(文)试卷(解析版) 题型:填空题
(6分)工业制硅的主要化学反应是: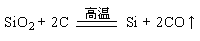
请回答下列问题:
(1)该反应的反应类型属于 (填字母)
A.复分解反应 B.化合反应 C.分解反应 D.置换反应
(2)该反应中SiO2的作用是 (填“氧化剂”或“还原剂”)
(3)硅是人类将太阳能转换为 的常用材料。
查看答案和解析>>
科目:高中化学 来源:2014-2015辽宁省大连市高二上学期期末考试化学(理)试卷(解析版) 题型:填空题
(10分)研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。在催化剂作用下,CO可用于合成甲醇:CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
(1)若在恒温恒压的条件下,向密闭容器中充入4 mol CO和8 mol H2,合成甲醇,平衡时CO的转化率与温度、压强的关系如图所示:
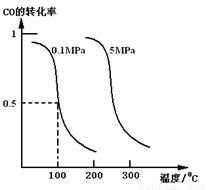
①该反应的正反应属于________反应(填“吸热”或“放热”)。
②在0.1 MPa、100 ℃的条件下,该反应达到平衡时容器内气体的物质的量为_________mol。
(2)若在恒温恒容的条件下,向上述平衡体系中充入4 mol CO,8 mol H2,与(1)相比,达到平衡时CO转化率_______(填“增大”,“不变”或“减小”), 平衡常数K_______(填“增大”,“不变”或“减小”)。
(3)在上述合成甲醇的反应中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015辽宁省大连市高二上学期期末考试化学(理)试卷(解析版) 题型:选择题
用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,硫酸铜有剩余,若想将溶液恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解),则需加入下列哪种物质
A.CuO B.Cu(OH)2 C.CuSO4 D.H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015辽宁省大连市高二上学期期末考试化学(理)试卷(解析版) 题型:选择题
已知4NH3 + 5O2 = 4NO + 6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是
A.4v(NH3) = 5v(O2) B.5v(O2) = 6v(H2O)
C.2v(NH3) = 3v (H2O) D.4v(O2) = 5v(NO)
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省高一上学期期末考试化学试卷(解析版) 题型:计算题
(一)(10分)标准状况下,向100 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液显碱性(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:

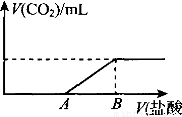
已知图中B点位置固定,V(B)=300 ml。,而点A、C可在各自的轴上移动。
(1)原溶液的物质的量浓度为 mol/L。B点时,最终所得溶液中的溶质的物质的量浓度是 mol/L。(两种溶液混合时体积可以直接相加)。
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
V(A)的取值 | V(A)=0 | 0<V(A)<150 | V(A)=150 | 150<V(A)<300 |
溶质的成分 | ① | ② | ③ | ④ |
(3)取V(A)=100 mL时对应的溶液M 30 mL与等体积的l mol/L的盐酸按各种可能的方式混合,产生的气体体积V mL,则V的取值范围是 。
(二)(5分)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完 全沉淀,沉淀质量为39.2 g。求
①混合物中Cu的质量为_____________
②产生的NO在标准状况下的体积为_____________
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省高一上学期期末考试化学试卷(解析版) 题型:选择题
下列实验操作中,不正确的是
A.在蒸发食盐水时,边加热边用玻璃棒搅拌
B.焰色反应实验前,铂丝应先用盐酸洗涤
C.实验室制备氢氧化亚铁时,滴加氢氧化钠溶液的胶头滴管伸入液面下
D.配制一定物质的量浓度的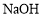 溶液,将
溶液,将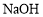 固体放在容量瓶中加水溶解
固体放在容量瓶中加水溶解
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三12月月考化学试卷(解析版) 题型:填空题
(16分)平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等。
(1)现有容积为1 L的恒温恒容密闭容器,向其中加入2 mol A气体和2 mol B气体后发生如下反应:A(g)+B(g) C(g) △H=-a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
C(g) △H=-a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
①20s内B气体的平均化学反应速率为___________。
②下列各项中能说明该反应已经达到平衡状态的有 。
A.容器中气体的平均相对分子质量不随时间而变化
B.消耗1molA的同时消耗1molB
C.容器中气体的密度不随时间而变化
D.C的体积分数不随时间而变化
③保持容器温度和容积不变,若开始时向容器中加入2molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是____________(填字母)。
(A)Q1 + Q2 = 2a (B) Q1 + 2Q2 < 2a (C)Q1 + 2Q2 > 2a(D)Q1 + Q2 < a
④在原平衡基础上,保持容器温度和容积不变,向容器中再通入bmolA气体,,重新达平衡后,B气体的转化率为60%,则b= 。
(2)亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3。
25℃时H3PO3 H++H2PO的电离常数Ka=8.0×10-3 mol·L-1,该温度下NaH2PO3
H++H2PO的电离常数Ka=8.0×10-3 mol·L-1,该温度下NaH2PO3
水解反应的平衡常数Kh= mol·L-1。亚磷酸钠具有强还原性,可使碘水褪色。若向NaH2PO3溶液中加入少量I2,则溶液中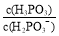 将 (填“变大”“变小”“不变”)。
将 (填“变大”“变小”“不变”)。
(3)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。
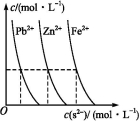
如果向三种沉淀中滴加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com