
分析 氯化铝溶液中,铝离子水解生成氢氧化铝和氢离子,导致溶液显示酸性,实质是:Al3++3H2O?Al(OH)3+3H+,把AlCl3溶液蒸干灼烧,水解平衡向右移动,生成氢氧化铝,同时盐酸挥发,最后得到的主要固体产物是氢氧化铝,所以要抑制水解,使水解平衡逆向移动.
解答 解:氯化铝溶液中,铝离子水解生成氢氧化铝和氢离子,导致溶液显示酸性,实质是:Al3++3H2O?Al(OH)3+3H+,把AlCl3溶液蒸干灼烧,水解平衡向右移动,生成氢氧化铝,同时盐酸挥发,最后得到的主要固体产物是氢氧化铝,所以要抑制水解,使水解平衡逆向移动,在氯化氢氛围中加热蒸干,故答案为:在干燥的HCl氛围中加热蒸干氯化铝溶液.
点评 本题考查盐类的水解以及铝的化合物知识,侧重于基础知识的考查,为高频考点,注意把握盐类水解的原理以及影响因素,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,18gD2O中所含的电子数为10NA | |
| B. | 200mL0.5mol•L-1的Na2CO3溶液中,由于CO32-水解,所以阴离子数目小于0.1NA | |
| C. | 精炼铜时,当阳极质量减少6.4g时,电路中转移电子数不一定为0.2NA | |
| D. | 5.6g铁与足量稀硫酸反应失去电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中化合价升高的元素是NH3中的H | |
| B. | 该反应利用了Cl2的强还原性 | |
| C. | NH3在反应中得到电子 | |
| D. | 生成1molN2有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
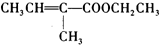 ;以化合物A为原料合成F的工艺流程如图:
;以化合物A为原料合成F的工艺流程如图:

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.如表中液体X和固体Y的组合,不符合题意的是( )
如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.如表中液体X和固体Y的组合,不符合题意的是( )| ① | ② | ③ | ④ | |
| X | 水 | 水 | 稀硫酸 | 双氧水 |
| Y | 硝酸铵 | 氢氧化钠 | 氯化钠 | 二氧化锰 |
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO${\;}_{4}^{2-}$的摩尔质量是96g/mol | |
| B. | 1molH2中含有2molH | |
| C. | 1molH2O的质量等于NA个H2O质量的总和 | |
| D. | 1molO2的质量为32g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com