
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
(1)X极与电源的 (填“正”或“负”)极相连,氢气从 (选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为 (填“阴离子”或“阳离子”,下同)交换膜,N为 交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为 。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是 ,转移的电子数为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
(9分)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiCIO4。溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。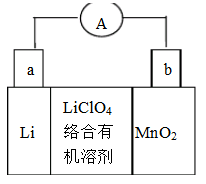
回答下列问题:
(1)外电路的电流方向是由____极流向____极。(填字母)
(2)电池正极反应式为____。
(3)是否可用水代替电池中的混合有机溶剂?____(填“是”或“否”),原因是____________。
(4)MnO2可与KOH和KClO3,在高温下反应,生成K2MnO4,反应的化学方程式为_______________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氧化钠辖液电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。[来源:学科网ZXXK]
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通如量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F=9.65×l04C · mol-1列式计算),最多能产生的氯气体积为 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
可以将氧化还原反应2H2+O2 2H2O设计成原电池。
2H2O设计成原电池。
(1)利用氢气和氧气、氢氧化钾溶液构成燃料电池,则负极通的气体应是 ,正极通的气体就是 ,电极反应为:正极 ,负极 。
(2)如果把KOH改为稀硫酸作电解质,则电极反应为:正极: ,负极: 。
(3)(1)和(2)的电解质溶液不同,反应进行后,其溶液的pH各有何变化? 。
(4)如把H2改为甲烷,KOH溶液作电解质溶液,则电极反应为:正极: ,负极: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示,在不同的电解质溶液中可以组成不同的电池。
(1)①当电解质溶液为稀硫酸时,Fe电极是 (填“正”或“负”)极,其电极反应式为
。
②当电解质溶液为NaOH溶液时,Al电极是 (填“正”或“负”)极,其电极反应式为 。
(2)若把铝改为锌,电解质溶液为浓硝酸,则Fe电极是 (填“正”或“负”)极,其电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示,用石墨电极电解氯化铜溶液。查阅资料可知,CuCl42—显黄色,氯化铜溶液显蓝绿色或黄绿色;向体积相同浓度分别为0.01 mol/L、0.05 mol/L、0.1 mol/L、0.5 mol/L的氯化铜溶液中加入NaCl至饱和,对比发现,溶液的颜色由黄绿色向蓝绿色转变。
请回答下列问题:
(1)阳极上的气体呈________色,检验该气体可用________________。
(2)写出电解的离子方程式:________________。
(3)实验时,装置中阴极溶液颜色由蓝绿色变为黄绿色,原因是________。
(4)取出阴极的石墨棒,发现表面有浅蓝色固体,试设计实验探究此浅蓝色固体的成分:
____________________________________________________。
(5)为什么要设计连接后面的装置?
______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
(1)“热敷袋”放出的热量是利用铁发生了 反应放出热量。
(2)炭粉的主要作用是 。
(3)加入氯化钠的主要作用是 。
(4)木屑的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙的实验装置如图所示,丙、丁分别是氯碱工业生产示意图和制备金属钛的示意图。
请回答下列问题:
(1)写出甲装置中碳棒表面的电极反应式:_________________________
(2)已知:5Cl2+I2+6H2O=10HCl+2HIO3。若将湿润的淀粉KI试纸置于乙装置中的碳棒附近,现象为________________________________;若乙装置中转移0.02 mol电子后停止实验,烧杯中溶液的体积为200 mL,则此时溶液的pH=________。(室温条件下,且不考虑电解产物的相互反应)
(3)工业上经常用到离子交换膜,离子交换膜有阳离子交换膜和阴离子交换膜两种,阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。当乙装置中的反应用于工业生产时,为了阻止两极产物之间的反应,通常用如丙图所示的装置,Na+的移动方向如图中标注,则H2的出口是________(填“C”、“D”、“E”或“F”);________(填“能”或“不能”)将阳离子交换膜换成阴离子交换膜。
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaO作电解质,利用丁装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极的电极反应式:_____________________________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)____________________________________ __。
③电解过程中需定期更换阳极材料的原因是
___________________ __________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是两座工厂的主要生产流程以及它们之间的生产关系
回答下列问题:
(1)与上图中“设备A”的作用相当的实验装置是 。
(2)“溶液B”也可以用下列物质中的什么物质代替? 。
a.KAl(SO4)2·12H2O b.ClO2 c.大量O3 d.K2Cr2O7 e.活性炭
(3)聚氯化铝在生产过程中作 剂,其作用是 ,可用离子方程式表示其化学原理如下(用Al3+代表聚氯化铝): 。
(4)上图中下方的工厂主要生产两种气体和一种常见强碱,通常称为 工业。
(5)加入“三种试剂”主要是为了除去粗食盐水中的Ca2+、Mg2+、SO42-等杂质,按加入的先后次序写出化学式 。
(6)制取“溶液B”的方法现在已作了改进,其原理图,用离子方程式表示该装置中发生的反应: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com