
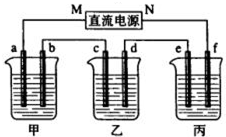
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
| ||
| 109g×5.51% |
| 40g/mol |
| 0.15mol |
| 0.1L |


科目:高中化学 来源: 题型:
| 阳离子 | Na+、K+、Cu2+ | ||
| 阴离子 | SO
|

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
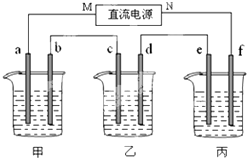 如图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极.接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g.据此回答问题:
如图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极.接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g.据此回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com