
| A. |  如图夹紧弹簧夹,由漏斗中加水至产生液面差,一段时间后液面差不变,说明气密性良好 | |
| B. | 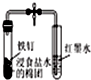 如图打开弹簧夹,红墨水倒吸入导气管中,说明铁钉发生了吸氧腐蚀 | |
| C. | 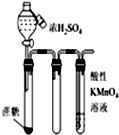 如图滴入浓硫酸后,高锰酸钾溶液褪色,说明浓硫酸使蔗糖脱水的同时还产生了二氧化碳 | |
| D. | 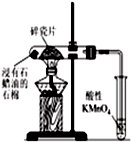 如图加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯 |
分析 A.如气密性良好,则由漏斗中加水至产生液面差,一段时间后液面差不变;
B.红墨水倒吸入导气管中,说明左侧试管内压强减小;
C.二氧化碳与高锰酸钾不反应;
D.乙烯可被酸性高锰酸钾氧化.
解答 解:A.实验前检查该装置气密性的方法是:打开旋塞,从长颈漏斗口注水至液面高于漏斗下端,关闭止水夹,继续注水,使漏斗中液面略高于试管中液面,一段时间后,高度差不变,说明气密性良好,故A正确;
B.红墨水倒吸入导气管中,说明左侧试管内压强减小,说明铁发生吸氧腐蚀,故B正确;
C.二氧化碳与高锰酸钾不反应,应生成二氧化硫,故C错误;
D.乙烯可被酸性高锰酸钾氧化,加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯,故D正确.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握化学反应原理、实验装置的作用、实验技能为解答的关键,侧重学生的分析、实验能力的考查,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:推断题
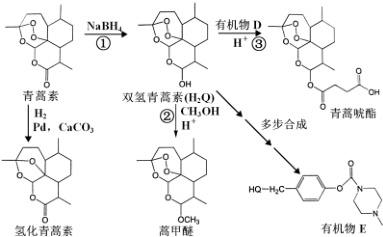
 .
. 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH 溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH 溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有 4 种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有 4 种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:填空题
FeCO3与砂糖混用可作补血剂。以黄铁矿烧渣(含CuO、Fe2O3、FeO、SiO2、Al2O3等)为主要原料制备FeCO3的流程如下:
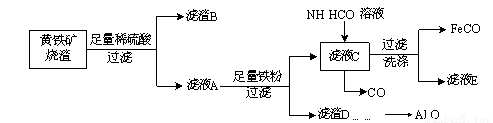
(1)质量分数为30%(密度是1.176 g·cm-3)的稀硫酸的物质的量浓度为 。
(2)检验滤液A中存在Fe2+的试剂是 。
(3)加入足量铁粉的作用除调节pH使Al3+转化为Al(OH)3沉淀外,还有两个作用,写出其中一个反应的离子方程式: 。
(4)写出滤液C与NH4HCO3溶液反应的离子方程式: 。
(5)FeCO3在空气中灼烧可制得铁系氧化物材料。已知25℃,101 kPa时:
4Fe(s)+3O2(g) 2Fe2O3 ΔH=﹣1648 kJ·mol-1
2Fe2O3 ΔH=﹣1648 kJ·mol-1
C(s)+O2(g) CO2(g) ΔH=﹣393 kJ·mol-1
CO2(g) ΔH=﹣393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g) 2FeCO3(s) ΔH=﹣1480 kJ·mol-1
2FeCO3(s) ΔH=﹣1480 kJ·mol-1
写出FeCO3在空气中灼烧生成Fe2O3的热化学方程式: 。
(6)某兴趣小组为充分利用副产品,欲利用滤渣D为原料制取Al2O3,请补充完成实验步骤:向滤渣D中加入适量NaOH溶液, 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列有关环境问题的做法错误的是
A.生活污水使用明矾杀菌消毒 B.向燃煤中加入适量石灰石“固硫”
C.推广使用可降解塑料防止白色污染 D.提倡公交出行可减少氮氧化物排放
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将CO2通入0.1 mol•L-1Na2CO3溶液中至溶液中性,则溶液中2c (CO32ˉ)+c (HCO3ˉ)=0.1 mol•L-1 | |
| C. | 根据上表,水解方程式ClOˉ+H2O?HClO+OHˉ的水解常数K≈10ˉ7.6 | |
| D. | 向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性由强到弱的顺序:Z、W、X | |
| B. | 原子半径由大到小的顺序:W、Z、Y、X | |
| C. | 原子最外层电子数由多到少的顺序:Y、X、W、Z | |
| D. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y、W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com