
����Ŀ����������A��K֮���������ͼ��ʾ��ת����ϵ������D��EΪ���ʣ���ش��������⣨ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������
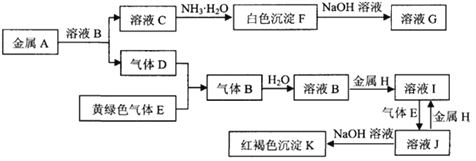
��1��д���������������ʵ����ƣ�B�� __________��G��____________
��2����Ӧ��F��G���Ļ�ѧ����ʽ��_____________________________________________
��3����Ӧ��J��I�������ӷ���ʽ��_____________________________________________
��4����ҺI�л�����ҺJ����ȥJ�ķ����ǣ�________________________________________________________________
��5��������ҺI�������ӵķ����ǣ�__________________________
���𰸡� �Ȼ��� ƫ������ Al(OH)3+NaOH=NaAlO2+2H2O 2Fe3++Fe=3Fe2+ �������������ۣ����ˣ� ȡ������ҺI���Թ��У��μӼ������軯����Һ����Һ�����ɫ���ټӼ�����ˮ����Һ��Ϊ��ɫ��֤����Һ�к���Fe2+��
��������C�мӰ�ˮ���ɰ�ɫ����F��F������NaOH��Һ�У���֪FΪAl(OH )3����C�к���Al3+���Ӷ�AΪAl��EΪCl2��DΪ��������Cl2��Ӧ������һ������B�����Ʋ�BΪHCl����֤��֪BȷΪHCl���ɺ��ɫ����K��֪KΪFe(OH)3������HΪFe��
��1�������������֪B���Ȼ��⡢FΪAl(OH )3����NaOH��Ӧ����Na2AlO2��G������Ϊƫ�����ơ�
��2��Al(OH )3��NaOH��Ӧ����Na2AlO2��H2O����ѧ����ʽΪ��Al(OH)3+NaOH=NaAlO2+2H2O��
��3������HΪFe��BΪHCl������IΪFeCl2��JΪ FeCl3��J��I�����ӷ���ʽΪ��2Fe3++Fe=3Fe2+��
��4��FeCl2��Һ�л���FeCl3���ɼ���������Fe��ʹFe3+ת��ΪFe2+��Ȼ����ˡ�
��5������FeCl2��Fe2+�ķ�����ȡ������ҺI���Թ��У��μӼ������軯����Һ����Һ�����ɫ���ټӼ�����ˮ����Һ��Ϊ��ɫ��֤����Һ�к���Fe2+��
�����͡��ƶ���
��������
23
����Ŀ����ͼת����ϵ�У�A��B��C��D��E���Ƕ�����Ԫ�صĵ��ʣ��ڳ��³�ѹ��A�ǹ��壬��������壬��C�ʻ���ɫ����̨��H��I������������ʱ�������̡�������G����ɫ��ӦΪ��ɫ����Ӧ�ٺ͢ھ�����Һ�н��С�
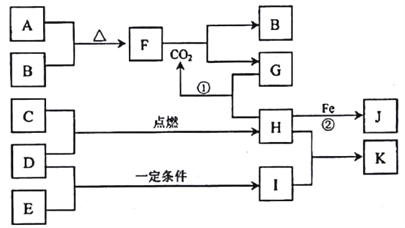
�밴Ҫ��ش��������⡣
(l)д���������ʵĻ�ѧʽ��D________��F_______________��
(2)��Ӧ�ٵ����ӷ���ʽΪ_____________��
(3)��K��Һ�м��������ữ����������Һ����Ӧ������Ϊ__________��
(4)����������Cͨ��ʢ�е���KI��Һ���Թ��У�Һ���Ϊ��ɫ���÷�Ӧ�����ӷ���ʽΪ_________����˵������C��������_______�ڵ��ʵ⣨�ǿ������������
(5)��J��Һ�е���NaOH��Һʱ�����ɵĻҰ�ɫ����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��д�������ɻҰ�ɫ��ɺ��ɫ�Ļ�ѧ����ʽ��______________��
���𰸡� H2 Na2O2 2H++CO32-=H2O+CO2�� ������ɫ���� Cl2+2I-=I2+2Cl- ǿ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
��������A��B��C��D��E���Ƕ�����Ԫ�صĵ��ʣ�CΪ����ɫ���壬��CΪCl2��������H��I������������ʱ�������̣���DΪH2��HΪHCl��EΪN2��IΪNH3������KΪNH4Cl����Ӧ��ΪFe�����ᷴӦ����JΪFeCl2��������G����ɫ��ӦΪ��ɫ�������ᷴӦ����CO2����GΪNa2CO3��NaHCO3��A�ǹ��壬��������壬���Ԫ���غ㼰ת����ϵ��֪��AΪNa��BΪO2��A��B��Ӧ����F����FΪNa2O2����F�������̼�ķ�Ӧȷ��Gֻ��ΪNa2CO3����
��1��������������֪DΪH2��FΪNa2O2����2����Ӧ��Ϊ������̼���Ƶķ�Ӧ�������ӷ�ӦΪ2H++CO32-=H2O+CO2������3��KΪNH4Cl�����������ữ����������Һ���Ȼ�������������ʵ�������dz��ְ�ɫ��������4������������Cͨ��ʢ�е���KI��Һ���Թ��У�Һ���Ϊ��ɫ�����������������������ɵⵥ�ʣ����ӷ�ӦΪCl2+2I-=I2+2Cl-����������������ǿ�ڵ������������5��JΪFeCl2������NaOH��Һʱ�����ɵĻҰ�ɫ����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ������4Fe(OH)2+O2+2H2O=4Fe(OH)3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���֪��Ksp(AgCl)=1.8��10-10��Ksp(Ag2CrO4)=l.1��10-12�Լ�Ksp[Cu(OH)2] =2��10-20������˵���������
A. ������AgCl������Һ��Ag2CrO4������Һ�����ʵ���Ũ�ȱȽϣ�c(AgCl)<c(Ag2CrO4)
B. �����£���0.010molL-1��AgNO3��Һ�У�AgCl��Ag2CrO4�ֱ��ܴﵽ��������ʵ���Ũ�ȱȽϣ�c(AgCl)<c(Ag2CrO4)
C. ijCuSO4��Һ��c(Cu2+)=0.02 molL-1����Ҫ����Cu(OH)2������Ӧ������Һ��pH��ʹ֮����5
D. Ҫʹ0.2molL-1 CuSO4��Һ��Cu2+������Ϊ��ȫ��ʹCu2+Ũ�Ƚ���ԭ����ǧ��֮һ������Ӧ����Һ�����NaOH��Һ��ʹ��ҺPHΪ6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ����Ũ��Ϊ1mol/L�ģ�NH4��2SO4����NH4��2CO3����NH4��2Fe(SO4)2����Һ�У�����c(NH4+)�ֱ�Ϊa��b��c(��λΪmol/L)�������ж���ȷ����
A. a=b=c B. a>b>c C. a>c>b D. c>a>b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����֮��Ϊ16��7��6����������SO2��CO��NO�����Ӹ���֮��Ϊ________����ԭ�Ӹ���֮��Ϊ____________����ͬ���������֮��Ϊ________��
(2)ij����������Ļ�ѧʽΪRO2���ڱ�״���£�0.92 g ������������Ϊ448 mL������������Ħ������Ϊ________��R�����ԭ������Ϊ________��RO2�Ļ�ѧʽΪ______��
(3)�����£���27.5 gˮ���ܽ�12.5 g CuSO4��5H2O��ǡ�ôﵽ���ͣ�����Һ���ܶ�Ϊ1.60 g/cm3�������Һ��CuSO4�����ʵ���Ũ��Ϊ____________������ȡ��20.0 mL����Һ�����Ũ��Ϊ1.00 mol/L��ϡ��Һ����ϡ�ͺ���Һ�������________mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ú�������л���������ӽ��в��Բ���¼���ɳ����жϸ��л������ӵ�еģ�������
A.ͬ���칹����
B.ԭ�Ӹ���
C.��������
D.���ۼ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С�����������װ�öԽ�̿��ԭ����������������ijɷֽ���̽����

��֪��PdCl2��Һ�����ڼ���CO����Ӧ�Ļ�ѧ����ʽΪCO + PdCl2 + H2O = CO2 + 2HCl + Pd��
��������ɫ�����ٷ�ĩ��ʹ��Һ����ǣ���
��1��ʵ��ʱҪͨ���㹻��ʱ���N2����ԭ����_ ��
��2��װ��B��������_ ��
��3��װ��C��D����ʢ�Լ��ֱ�Ϊ_ ___ ��_ ___����װ��C��D����Һ������ǣ��Ҿ�����������������ʵ�����ȣ���÷�Ӧ�Ļ�ѧ����ʽΪ_ ��
��4����װ�õ�ȱ����_ ��
��5�����ϱ�����������Ӧ�ڽ�̿����ʱ�����ɸ�����SiC��ȡ18 g SiO2��8.4 g��̿��ַ�Ӧ���ռ�����״���µ�����13��44 L���ٶ��������ֻ��CO���������ֻ��Si��SiC����Si��SiC�����ʵ���֮��Ϊ_ ��
��6�����ʵ��֤��̼������Աȹ����ǿ��_ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����11�֣�Ϊ��̽��Cl2��SO2ͬʱͨ��H2O�����ķ�Ӧ��ijУ��ѧ��ȤС��ͬѧ���������ͼ��ʾ��ʵ��װ�á�
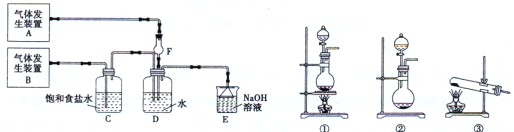
����գ�
��1���û�ѧ��ȤС���ͬѧΪ��ȡCl2��SO2���壬�ֲ���Na2SO3��70%��Ũ����Ϊԭ����ȡSO2������MnO2��Ũ���ᣨ12 mol��L-1��Ϊԭ����ȡCl2���ڴ�ʵ���У�F������������ �����巢��װ��BӦѡ����������������װ���е� ��ѡ����ţ���
��2��Dװ������Ҫ��Ӧ�����ӷ���ʽΪ�� ��
��3��Ϊ��֤ͨ��Dװ����������Cl2��������SO2��������ȤС���ͬ!ѧ���������Լ����Ȼ�����Һ���Ȼ�������Һ�����軯����Һ��������Һ��Ʒ����Һ�����Ը��������Һ��
��Cl2����ȡ����D����Һ�μ���ʢ�� ���Լ����ƣ���ͬ�����Թ��У��ټ�������������� ��˵��Cl2������
��SO2������ȡ����D����Һ�μ���ʢ�� ���Թ��ڣ������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�����������10 ��Ԫ�أ��ش����м��⣮
�� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | C | N | F | Na | ||||
3 | Na | Mg | Al | Si | S | Cl |
��1���ǽ�������ǿ��Ԫ������
��2��Ne ԭ�ӽṹʾ��ͼΪ��
��3��C ��N �У�ԭ�Ӱ뾶��С������
��4����ˮ����Ư�����ã����������к������HCl����HClO����
��5��Ԫ������������Ӧ��ˮ�����У�������ǿ�������ѧʽ���������Ե������ѧʽ����
��6��Ԫ�ع�������ﳣ������������һ�ָ����ܵ��ִ�ͨѶ���ϵ����ƣ���
��7����ͼΪij�л�������ģ�ͣ����� ![]() ������ԭ�Ӵ���
������ԭ�Ӵ��� ![]() ̼ԭ�ӣ���
̼ԭ�ӣ��� 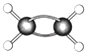 ���л�����̼Ԫ������Ԫ�ص�������m��C����m��H��= �� �����ԭ������C��12��H��1��
���л�����̼Ԫ������Ԫ�ص�������m��C����m��H��= �� �����ԭ������C��12��H��1��
��8��þ�������������ɻ����������Ҫ���ϣ�д����ҵ�ϵ�������Ȼ�þ��ý���þ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com