




 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
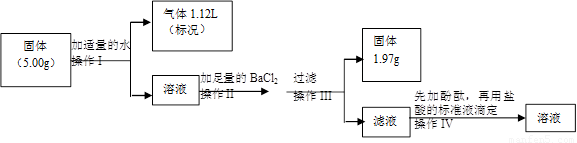
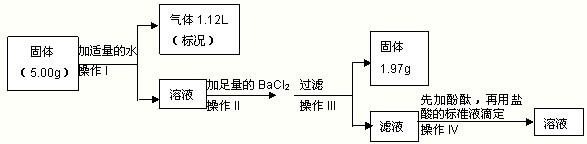
常温下将一块钠露置在空气中一段时间后,甲、乙两位同学把固体分成两份,各取一份同时进行实验,欲探究其组成和含量。请根据要求回答下列问题。
甲同学:将一份放入烧瓶中,加入稀硫酸后,生成无色无味的气体,据分析推理可能有二氧化碳和氢气,然后进行气体成份的验证实验。
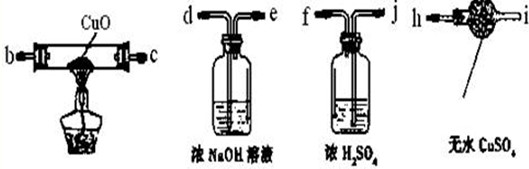
(1)为验证气体产物中是否含有二氧化碳和氢气,需从下图中选择必要的仪器和药品,设计一套装置验证气体成份。装置的连接顺序为:d→ → → →
→ → 。(填下列装置的接口字母)

(2)实验过程中观察到石灰水变浑浊,由此可判断原固体中含有的物质是________
(填化学式)。
乙同学将另一份进行以下实验。

(3)用浓盐酸配制500mL 3.00mol·L-1的稀盐酸时,需要使用的玻璃仪器除了量筒、烧杯、胶头滴管、玻璃棒以外,还有 。
(4)在操作II中,发生反应的离子方程式为 。
(5)操作IV中用盐酸标准液滴定滤液时,滴定终点的现象是 。
(6)若操作IV中,消耗3.00mol·L-1的盐酸标准液50.00 mL,通过计算判断,5.00g固体中是否含有NaOH________(填有或无),质量是________g
(若你认为无NaOH,则此空不用答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下将一块钠露置在空气中一段时间后,甲、乙两位同学把固体分成两份,各取一份同时进行实验,欲探究其组成和含量。请根据要求回答下列问题。
甲同学:将一份放入烧瓶中,加入稀硫酸后,生成无色无味的气体,据分析推理可能有二氧化碳和氢气,然后进行气体成份的验证实验。
(1)为验证气体产物中是否含有二氧化碳和氢气,需从下图中选择必要的仪器和药品,设计一套装置验证气体成份。装置的连接顺序为:d→ → → →
→ → 。(填下列装置的接口字母)
(2)实验过程中观察到石灰水变浑浊,由此可判断原固体中含有的物质是________
(填化学式)。
乙同学将另一份进行以下实验。

(3)用浓盐酸配制500mL 3.00mol·L-1的稀盐酸时,需要使用的玻璃仪器除了量筒、烧杯、胶头滴管、玻璃棒以外,还有 。
(4)在操作II中,发生反应的离子方程式为 。
(5)操作IV中用盐酸标准液滴定滤液时,滴定终点的现象是 。
(6)若操作IV中,消耗3.00mol·L-1的盐酸标准液50.00mL,通过计算判断,5.00g固体中是否含有NaOH________(填有或无),质量是________g
(若你认为无NaOH,则此空不用答)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省龙岩市高三上学期期末化学卷 题型:填空题
常温下将一块钠露置在空气中一段时间后,甲、乙两位同学把固体分成两份,各取一份同时进行实验,欲探究其组成和含量。请根据要求回答下列问题。
甲同学:将一份放入烧瓶中,加入稀硫酸后,生成无色无味的气体,据分析推理可能有二氧化碳和氢气,然后进行气体成份的验证实验。
(1)为验证气体产物中是否含有二氧化碳和氢气,需从下图中选择必要的仪器和药品,设计一套装置验证气体成份。装置的连接顺序为:d→ → → →
→ → 。(填下列装置的接口字母)

(2)实验过程中观察到石灰水变浑浊,由此可判断原固体中含有的物质是________
(填化学式)。
乙同学将另一份进行以下实验。
(3)用浓盐酸配制500mL 3.00mol·L-1的稀盐酸时,需要使用的玻璃仪器除了量筒、烧杯、胶头滴管、玻璃棒以外,还有 。
(4)在操作II中,发生反应的离子方程式为 。
(5)操作IV中用盐酸标准液滴定滤液时,滴定终点的现象是 。
(6)若操作IV中,消耗3.00mol·L-1的盐酸标准液50.00 mL,通过计算判断,5.00g固体中是否含有NaOH________(填有或无),质量是________g
(若你认为无NaOH,则此空不用答)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com