
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
分析 (1)根据反应前后溶液温度变化判断反应热,然后得出反应物与生成物总能量的大小关系;
(2)实验4和5中,除了金属的状态不同外,其它条件都相同;
(3)探究浓度对反应速率的影响,则除了浓度不同外,其它量必须相同,据此进行判断;
(4)根据表中6和7、8和9的数据及对比实验要求可知,该实验还探究了温度对反应速率的影响.
解答 解:(1)根据表中反应前后溶液温度升高可知,该反应为放热反应,则反应物总能量大于生成物总能量,
故答案为:<;
(3)实验4和5,金属和稀硫酸的量相同,只有金属的状态不同,探究的是固体反应物的表面积对反应速率的影响;能够探究固体反应物的表面积对反应速率的影响的实验还有1和2,
故答案为:固体反应物的表面积;1和2;
(3)仅表明反应物浓度对反应速率产生影响的实验,金属的状态相同,或者为丝状,或者为粉末,除了反应物浓度不同以外,其它量必须相同,满足条件的有:1、3、4、6、8和2、5,
故答案为:1、3、4、6、8或2、5;
(4)结合表中数据可知,本实验中,还探究了反应温度对化学反应速率的影响,如实验6和7、8和9,
故答案为:反应温度;6和7或8和9.
点评 本题考查影响化学反应速率的因素,题目难度中等,注意掌握影响化学反应速率的因素,明确对比实验设计的要求,试题侧重考查学生的分析能力及化学实验能力.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸 | |
| B. | 将0.1mol/L的NaOH溶液与0.5mol/L的CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是还原性糖 | |
| C. | 在密闭容器中加入1.5mol H2和0.5mol N2充分反应可得到NH3分子数为NA | |
| D. | 标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| B. | 常温下,16gO2和O3的混合气体中含有的氧原子数为NA | |
| C. | 标准状况下,22.4L NO和22.4LO2 混合后所得气体中分子总数为1.5NA | |
| D. | 将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
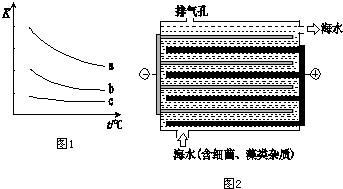
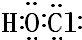 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
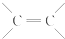 结构的有机物可被高锰酸钾溶液氧化成二元醇,如:CH2═CH2 $\stackrel{KMnO_{4}溶液}{→}$HOCH2CH2OH,现以甲基丙烯(
结构的有机物可被高锰酸钾溶液氧化成二元醇,如:CH2═CH2 $\stackrel{KMnO_{4}溶液}{→}$HOCH2CH2OH,现以甲基丙烯(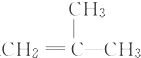 )为原料合成环状化合物F和高分子化合物E和G.
)为原料合成环状化合物F和高分子化合物E和G.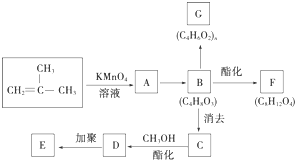
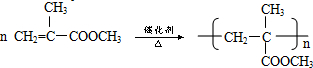
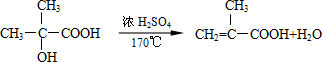 B→G的反应类型:缩聚,G的结构简式:
B→G的反应类型:缩聚,G的结构简式: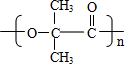 .
.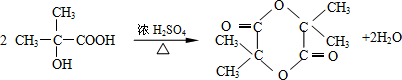 ,两分子B之间发生酯化反应除生成酯F外,还可能生成另外一种酯,该酯的结构简式为
,两分子B之间发生酯化反应除生成酯F外,还可能生成另外一种酯,该酯的结构简式为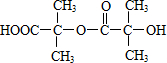 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去硬脂酸钠溶液中的甘油方法是:往溶液中加入饱和食盐水,分液 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. | 自来水厂常用某些含铝或铁的化合物作净水剂,是由于这些物质具有杀菌消毒作用 | |
| D. | 室温下,浓度均为0.1mol•L-1Na2S2O3和H2SO4溶液,分别取5mL与10mL混合,10mL与10mL混合,可验证Na2S2O3浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑧ | B. | ④⑤⑦ | C. | ④⑤⑧ | D. | ⑤⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com