

分析 A溶于水得沉淀和溶液,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁,将沉淀F溶于过量氢氧化钠溶液中,氧化铝能和氢氧化钠反应,氧化铁和氢氧化钠不反应,所以沉淀C是氧化铁,溶液D是偏铝酸钠溶液,溶液G中加入过量的氨水得到沉淀E为氢氧化铝,氢氧化铝与氢氧化钠溶液反应得到偏铝酸钠,将氢氧化铝加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵,以此解答该题.
解答 解:A溶于水得沉淀和溶液,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁,将沉淀F溶于过量氢氧化钠溶液中,氧化铝能和氢氧化钠反应,氧化铁和氢氧化钠不反应,所以沉淀C是氧化铁,溶液D是偏铝酸钠,溶液G中加入过量的氨水得到沉淀E为氢氧化铝,氢氧化铝与氢氧化钠溶液反应得到偏铝酸钠,将氢氧化铝加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵,
(1)分离溶液和固体的操作方法为过滤,故答案为:过滤;
(2)通过以上分析知,B是Al2O3,C是Fe2O3,D是NaAlO2,E是Al(OH)3,故答案为:Al2O3;Fe2O3;NaAlO2;Al(OH)3;
(3)沉淀F为氧化铝和氧化铁的混合物,氧化铝与NaOH溶液反应,反应的离子方程式为:Al2O3+2OH-=2AlO2-+2H2O,沉淀E与稀硫酸反应的离子方程式为:Al(OH)3+2H+=Al3++3H2O,
故答案为:Al2O3+2OH-=2AlO2-+2H2O;Al(OH)3+2H+=Al3++3H2O.
点评 本题考查了常见物质的分离与提纯方法综合应用,题目难度中等,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质,然后顺推或逆推或由两边向中间推得出其他物质,试题有利于培养学生的分析、理解能力及逻辑推理能力.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷 | |
| D. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、Y、Z的非金属性大小顺序一定是Z>Y>W | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | W、Z形成的某化合物常可用作萃取剂 | |
| D. | WY2分子中既有非极性键又有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
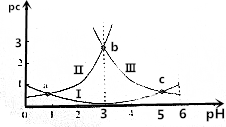
| A. | 曲线Ⅰ表示H2C2O4的变化 | |
| B. | pH=4时,c(HC2O4-)>c(C2O42-) | |
| C. | c(H2C2O4)+c(HC2O4-)+c(C2O42-)在a点和b点一定相等 | |
| D. | 常温下,$\frac{c({H}_{2}{C}_{2}{O}_{4})•c({C}_{2}{{O}_{4}}^{2-})}{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}$随pH的升高先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知下列反应:
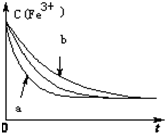
已知下列反应:| cm(I-)(mol/L)m | cn(Fe3+)[(mol/L)n] | v[mol/(L•s)] | |
| a | 0.20 | 0.80 | 0.032 |
| b | 0.60 | 0.40 | 0.144 |
| c | 0.80 | 0.20 | 0.128 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
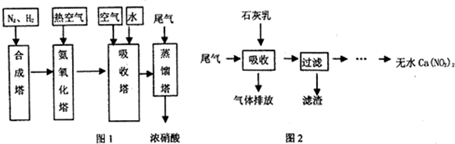
 CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1.
CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1. 6xH2O+(2x+3)N2.
6xH2O+(2x+3)N2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该粒子不显电性 | |
| B. | 该粒子的质量数与${\;}_{z}^{4}$He的相同,两者互为同位素 | |
| C. | 在元素周期表中与氢元素占同一位置 | |
| D. | 1mol该粒子的质量为8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径B>A>C>D | B. | 原子序数 a>b>c>d | ||
| C. | 离子半径C3->D->B+>A2+ | D. | 离子的还原性C3->D- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com