
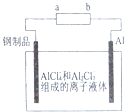
 已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )
已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )| A. | a电极的电极反应式为Ag2O+H2O+2e-=2Ag+2OH- | |
| B. | 银锌电池的电解质溶液可用稀硫酸 | |
| C. | 银锌电池放电时,负极附近溶液的pH增大 | |
| D. | Al电极上发生的电极反应式为Al+7AlCl4--3e-=4Al2Cl4- |
分析 根据电池反应式Ag2O+Zn=2Ag+ZnO知,失电子的物质作负极,得电子的物质作正极,原电池放电时,阳离子移向正极,根据电池电极附近氢离子或氢氧根离子浓度的变化判断溶液pH值的变化,铝电极为阳极,失去电子发生氧化反应.
解答 解:A、电池反应式Ag2O+Zn=2Ag+ZnO中,a为负极,失去电子发生氧化反应,故A错误;
B、电池反应式Zn+Ag2O+H2O═Zn(OH)2+2Ag中,电解质若为硫酸,则不可能产生碱性物质,故B错误;
C、极反应为Zn+2OH--2e-=Zn(OH)2,工作时负极区溶液的pH减小,故C错误;
D、Al电极上发生的电极反应式为Al+7AlCl4--3e-=4Al2Cl4,故D正确.
故选D.
点评 本题考查了原电池原理,难度不大,明确原电池正负极的判断方法、电极附近离子浓度的变化导致溶液pH值的变化即可解答本题.


 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH${\;}_{4}^{+}$ | SO${\;}_{4}^{2-}$ | NO3 | Cl- |
| 浓度/mol•L-l | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C17H19NO3 | B. | C17H21NO4 | C. | C17H25NO3 | D. | C25H27NO7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 说法 | 解释 |
| A | 加热条件下,浓硝酸与碳粉的反应可在铁制容器中进行 | 铁能被浓硝酸钝化 |
| B | 浓氨水可用于检验氯气管道泄露 | 过量的NH3与Cl2反应有白烟产生 |
| C | 用惰性电极电解MgCl2溶液可冶炼Mg | Mg2+在阴极得电子生成Mg |
| D | 葡萄糖和油脂均为人体所需能量的重要来源 | 二者在体内水解的产物被氧化可提供能量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (A-x+n) mol | B. | (A-x-n) mol | C. | (A-x+n)$\frac{w}{A}$ mol | D. | (A-x-n)$\frac{w}{A}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
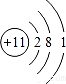 ,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)
,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com