
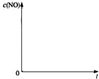
 目前正研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
目前正研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 |
T/℃ | NO初始浓度 (mol?L-1) |
CO初始浓度 (mol?L-1) |
催化剂的比表面积 ( m2?g-1) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
| 1 |
| 2 |
| (1.00×10-3-2.50×10-4)mol/L |
| 2s |
 ;
; ;
;| VL |
| 22.4mol?L-1 |
| V |
| 22.4 |
| ||
| VL |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 常温常压下,注射器甲中装有NO2气体,注射器乙中装有相同体积的空气,注射器与U 形管连通,如图所示,打开两个止水夹,同时向外拉两注射器的活塞,且拉动的距离相等,将会看到U形管中液面(不考虑此条件下NO2与水的反应)( )
常温常压下,注射器甲中装有NO2气体,注射器乙中装有相同体积的空气,注射器与U 形管连通,如图所示,打开两个止水夹,同时向外拉两注射器的活塞,且拉动的距离相等,将会看到U形管中液面(不考虑此条件下NO2与水的反应)( )| A、a端上升,b端下降 |
| B、a端下降,b端上升 |
| C、U形管中液面无变化 |
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关.
碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关.查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组在一次活动中,参照右图组装实验装置,以多孔碳棒为电极,电解质溶液用0.5mol?L-1NaOH溶液,电用3~6V直流电,发光二极管起辉电压为1.7V,电流为0.6mA.(提示:电解NaOH溶液实质上是电解水)
某研究性学习小组在一次活动中,参照右图组装实验装置,以多孔碳棒为电极,电解质溶液用0.5mol?L-1NaOH溶液,电用3~6V直流电,发光二极管起辉电压为1.7V,电流为0.6mA.(提示:电解NaOH溶液实质上是电解水)查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛应用.图中甲、乙为相互串联的两电解池.请回答:
电解原理在化学工业中有广泛应用.图中甲、乙为相互串联的两电解池.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A、该反应的化学方程式为3B+4D?6A+2C |
| B、反应进行到1 s时,v(A)=v(D) |
| C、反应进行到6 s时,B的平均反应速率为0.05 mol/(L?s) |
| D、反应进行到6 s时,各物质的反应速率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com