
【题目】氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ΔH=179.38 kJ·mol1
已知: 2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=159.47 kJ·mol1
NH2CO2NH4(s) ===CO(NH2)2(s)+H2O(l) ΔH=+72.49 kJ·mol1
则N2(g)+3H2(g) ===2NH3(g) ΔH= kJ·mol1。
(2)储氢材料领域是当前研究热点,LiBH4是一种良好的储氢材料。采用球磨法制备Al与LiBH4的复合材料,并对AlLiBH4体系与水反应产氢的特性进行下列研究:
①图甲为25℃水浴时每克不同配比的AlLiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的 (填字母)。

甲 乙
a.25℃时,纯LiBH4和铝均与水反应产生氢气
b.25℃时,复合材料中铝不能产生氢气,只是起到催化作用
c.25℃时,AlLiBH4复合材料中LiBH4含量25%,储氢效果最好
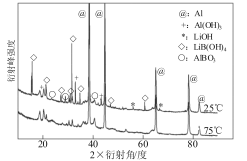
②图乙为25℃和75℃时,AlLiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X射线衍射图谱(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。从图分析,25℃时AlLiBH4复合材料中LiBH4与水反应生成的LiB(OH)4化学方程式为 ,铝元素的存在有多种形式,其中Al(OH)3产生的原因可能是 。
(3)已知H2S高温热分解制H2的反应为:H2S(g)![]() H2(g)+1/2S2(g)在恒容密闭容器中,控制不同温度进行H2S的分解实验,以H2S的起始浓度均为c mol·L1测定H2S的转化率,结果如下图所示:
H2(g)+1/2S2(g)在恒容密闭容器中,控制不同温度进行H2S的分解实验,以H2S的起始浓度均为c mol·L1测定H2S的转化率,结果如下图所示:

图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(S2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
(4)用惰性电极电解煤浆液的方法制H2的反应为:C(s)+2H2O(l) ===CO2(g)+2H2(g)现将一定量的1 mol·L1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL1~0.12g·mL1的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极)。则B极的电极反应式为 。

【答案】
(1)△H=―92.40 kJ·mol1(2分)
(2)①c(2分)
②LiBH4+4H2O===LiB(OH)4+ 4H2(2分) 反应生成LiOH使溶液呈碱性溶解铝(2分)
(3)0.2c/t mol·L1·min1(2分)
温度升高,反应速率加快,达到平衡所需的时间缩短(合理答案均可)(2分)
(4)2H++2e===H2↑(2分)
【解析】
试题分析:
(1)第一个方程式减去后两个即可得出该式的反应热;
(2)氧化还原反应:LiBH4+4H2O===LiB(OH)4+4H2 ,根据图像观察得出体系中含有氢氧化锂和硼酸锂,所以应是反应生成LiOH使溶液呈碱性溶解铝;
(3)反应经t min达到平衡,此时H2S的转化率为40%,反应中变化的浓度为0.4c mol·L1,S2是H2S变化一半,v(S2)=0.2c/t mol·L1·min1;温度升高,反应速率加快,达到平衡所需的时间缩短;
(4)B电极为阴极:2 H++2e===H2↑。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子反应方程式正确的是:( )
A. 过量的二氧化碳通入NaOH溶液中:CO2+OH-==HCO3-
B. 氯气通入水中:Cl2+H2O==Cl-+ClO- +2H+
C. 硫酸亚铁溶液加入过氧化氢溶液Fe2++2H2O2+4H+==Fe3++4H2O
D. 向AlCl3溶液中过量的氨水:Al3+十4NH3·H2O==AlO2-十4NH4+十2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子排布有能级顺序,若以E(nl)表示某能级的能量,以下各式中正确的是
A. E(4s)>E(3d)>E(3Px)>E(3Py)
B. E(3d)>E(4s)>E(3p)>E(3s)
C. E(5s)>E( 4f)>E(3Px)=E(3Py)
D. E(5s)>E(4s)>E( 4f)>E(3d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.增大体系压强,活化分子数增加,化学反应速率一定增大
B.加入反应物,使活化分子百分数增加,化学反应速率增大
C.活化分子间所发生的分子间的碰撞均为有效碰撞
D.升高温度,活化分子百分数增加,化学反应速率一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,c(NO)随时间的变化如表:
2NO2(g)体系中,c(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 0.10 | 0.05 | 0.04 | 0.03 | 0.03 | 0.03 |
(1)分析上表,该反应达到平衡状态所需时间是_________。
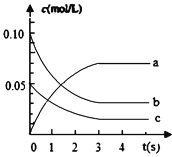
(2)上图中表示NO2的浓度变化曲线是_______________。
(3)用NO表示从0~2s内该反应的平均速率v=________。
(4)v(NO):v(O2) = ______________。
(5)达到平衡状态时O2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
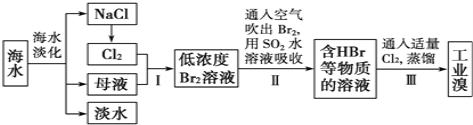
已知:
①海水中溴元素(以Br﹣表示)的浓度0.068g/L;
②Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.
(1)请写出两种海水淡化的方法:_______________________.
(2)海水中溴离子的物质的量浓度为____________________.
(3)步骤Ⅰ中已获得低溶度的含Br2溶液,步骤Ⅱ中又将Br2还原为Br﹣,步骤Ⅲ又得到Br2,其目的为__________________.
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________.
(5)工业溴提纯可用蒸馏法,蒸馏时加热方法最好采用_____,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________.
(6)Br2是有机合成工业中的重要原料,甲苯的一溴代物有多种,其中苯环上的一氯代物只有两种的结构简式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】
铝及其化合物在工农业生产生活中有着重要的用途。
(1)离子镀钛氮化铝是一种高强度的保护层,Ti基态核外电子排布式为 。
(2)AlCl3是有机反应中常用的催化剂。
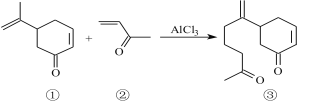
有机物①碳原子的杂化类型为 。1 mol有机物②分子中含有σ键的数目为 mol。
(3)一定条件下用Al2O3和CCl4反应制备COCl2,写出与COCl2互为等电子体的阴离子的化学式:
。
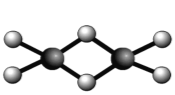
(4)双聚物Al2Cl6结构如图甲所示。在Al2Cl6中存在的相互作用有 (填字母)。
a.范德华力 b.离子键 c.共价键 d.氢键 e.配位键
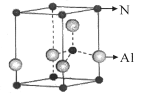
(5)氮化铝(其晶胞如图乙所示) 晶体中离铝原子最近的氮原子的个数为 。
甲 乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应平衡常数表达式为K=![]() 达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小.下列说法正确的是( )
达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小.下列说法正确的是( )
A. 反应的热化学方程式为NO2(g)+SO2(g) ![]() NO(g)(g)+SO3(g) △H>0
NO(g)(g)+SO3(g) △H>0
B. 一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深
C. 混合气体的平均摩尔质量保持不变,说明反应已达平衡
D. 使用合适的催化剂可使该反应的反应速率和平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二价金属的碳酸盐和碳酸氢盐的混合物与足量盐酸反应。消耗H+和产生CO2的物质的量之比为5:4,该混合物中碳酸盐和碳酸氢盐的物质的最之比为( )
A. 1:2 B. 2:3 C. 3:4 D. 4:5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com