
【题目】已知反应mX(g)+nY(g)![]() qZ(g)的△H < 0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的△H < 0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A. 通入稀有气体使压强增大,平衡将正向移动
B. X的正反应速率是Y的逆反应速率的n/m倍
C. 增加X的物质的量,Y的转化率降低
D. 降低温度,混合气体的平均相对分子质量变大
【答案】D
【解析】
A、恒容条件下,通入稀有气体使压强增大,反应混合物的浓度不变,正、逆反应速率不变;
B、可逆反应达平衡时不同物质表示的正、逆反应速率之比等于化学计量数之比;
C、反应物的起始物质的量之比等于化学计量数之比转化率相同;
D、降低温度平衡向正反应移动,因为m+n>q,反应混合气体总的物质的量减小,结合M=![]() 判断。
判断。
A、恒容条件下,通入稀有气体使压强增大,反应混合物的浓度不变,正、逆反应速率不变,平衡不移动,故A错误;
B、可逆反应达平衡时不同物质表示的正、逆反应速率之比等于化学计量数之比,X的正反应速率是Y的逆反应速率的![]() 倍,说明反应到达平衡,故B错误;
倍,说明反应到达平衡,故B错误;
C、反应物的起始物质的量之比等于化学计量数之比转化率相同,平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为m:n,故C错误;
D、降低温度平衡向正反应移动,因为m+n>q,反应混合气体总的物质的量减小,混合气体总质量不变,结合M=![]() 可以知道混合气体的平均摩尔质量增大,故降低温度,混合气体的平均相对分子质量增大,所以D选项是正确的。
可以知道混合气体的平均摩尔质量增大,故降低温度,混合气体的平均相对分子质量增大,所以D选项是正确的。
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g) ![]() cC(g)+dD(g),压缩容积到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),压缩容积到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A. A的转化率变大 B. 平衡向正反应方向移动
C. A的体积分数变大 D. a>c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
③H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
则下列说法正确的是
A. H2(g)的燃烧热为571.6 kJ·mol-1
B. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D. 2molH2(g)在足量氧气中完全燃烧生成气态水放出热量大于571.6kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A.b为电池的负极,甲醛被氧化
B.a极的电极反应为O2+4e-+4H+==2H2O
C.传感器工作过程中,电解质溶液中硫酸的浓度不变
D.当电路中转移1×10-4 mol电子时,传感器内参加反应的HCHO为0.75 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如图。
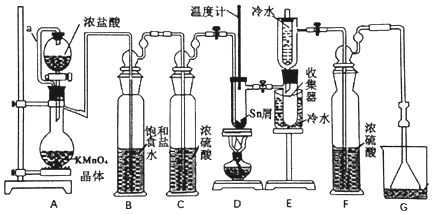
已知:①SnCl2、SnCl4有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | ﹣33 | 114 |
②SnCl4极易水解生成SnO2H2O。
回答下列问题:
(1)导管a的作用是____________________________________________________________,装置A中发生反应的离子方程式为________________________________________。
(2)当观察到装置F液面上方______________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是____________________________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为____________________________________________________________。
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,可采取的措施是____________________________________________________________。
(5)滴定分析产品中2价Sn(II)的含量:用分析天平称取5.000 g产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用0.1000 molL﹣1的碘标准溶液滴定至终点时消耗20.00 mL,则产品中Sn(II)的含量为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中键角由大到小排列的是
①BCl3 ②NH3 ③H2O ④PCl4+ ⑤BeCl2
A. ⑤④①②③ B. ④①②⑤③ C. ⑤①④②③ D. ③②④①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面对宏观事实的微观解释不正确的是( )
A.湿衣服晾在阳光充足的地方,容易干――温度升高,分子运动加快
B.固体碘(I2)和碘蒸气(I2)都能使淀粉溶液变蓝――同种分子化学性质相同
C.液态水变为水蒸气――分子体积变大
D.氧化汞受热分解生成汞和氧气――化学反应中分子发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组为测定空气中CO2的含量,进行了如下实验:
①配制0.1000 mol/L 和0.01000 mol/L的标准盐酸。
②将2~3滴酚酞加入未知浓度的Ba(OH)2溶液10.00 mL中,并用0.1000 mol/L的标准盐酸进行滴定,结果用去盐酸19.60 mL。
③用测定的Ba(OH)2溶液吸收定量空气中的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里加水至刻度线,取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
④过滤上述所得浊液。
⑤取滤液20.00 mL,用0.01000 mol/L的盐酸滴定,用去盐酸34.80 mL。
请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器?_____________________。
A.托盘天平 B.容量瓶 C.酸式滴定管 D.量筒 E.烧杯 F.胶头滴管 G.玻璃棒
(2)②操作中到达滴定终点时的现象是___________________________________________。
(3)Ba(OH)2溶液的物质的量浓度是________。
(4)此空气样品中含CO2的体积分数为________。
(5)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果________(填“偏大”“偏小”或“无影响”)。
(6)在第一次滴定的时候未润洗滴定管,会使测定结果_______(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com