
【题目】CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)CO2的分子结构决定了其性质和用途。
①CO2的电子式是_____________。
②在温度高于31.26 ℃、压强高于7.29×106Pa时,CO2处于超临界状态,称为超临界CO2流体,它可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,用超临界CO2萃取的优点有:___________(答出一点即可)。
(2)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如下图。

上图中CO2转化为CO的反应为:CO2(g)+H2(g) = CO(g)+H2O(g) △H= +41kJ/mol
已知:2CO2(g)+6H2(g) = C2H4(g)+4H2O(g) △H= -128kJ/mol
①则图中CO转化为C2H4的热化学方程式是____________________。
②关于X与Y的说法正确的是________(填序号〕。
a.实验式相同 b.都有4种一氯代物
c.都易使酸性KMnO4溶液褪色 d.互为同系物
③催化剂中Fe3O4的制备方法如下:将一定比例的FeCl2和FeCl3溶于盐酸,然后在 60 ℃下逐滴加入NaOH溶液至pH≈10,继续搅拌,得Fe3O4。该反应的离子方程式是____________________。
【答案】![]() 萃取剂与溶质更易分离或萃取剂更环保等 2CO(g)+4H2(g)= C2H4(g)+2H2O(g) △H= -210kJ/mol bd Fe2++2Fe3++8OH-=Fe3O4↓+4H2O
萃取剂与溶质更易分离或萃取剂更环保等 2CO(g)+4H2(g)= C2H4(g)+2H2O(g) △H= -210kJ/mol bd Fe2++2Fe3++8OH-=Fe3O4↓+4H2O
【解析】
(1)①CO2中每个碳原子形成4个共用电子对;
②与用有机溶剂萃取相比,用超临界CO2萃取,萃取剂与溶质更易分离,萃取剂更环保,对环境的污染少等;
(2)①根据盖斯定律计算;
②a.X与Y是两种烷烃,实验式分别为C5H12和C3H7,明显不同; b.分析对称性不难发现,它们的一氯代物都只有4种;
c.作为烷烃,均不能使酸性KMnO4溶液褪色;
d. X与Y是两种烷烃,分子式分别为C5H12和C6H14,二者互为同系物。
③题目已告知反应的微粒有Fe2+、Fe3+和OH-,生成物有Fe3O4,根据电荷守恒和原子守恒写出离子方程式。
(1)①CO2中每个碳原子形成4个共用电子对,其电子式为![]() ;
;
②与用有机溶剂萃取相比,用超临界CO2萃取,萃取剂与溶质更易分离,萃取剂更环保,对环境的污染少等;
因此,本题正确答案为:![]() ;萃取剂与溶质更易分离或萃取剂更环保等;
;萃取剂与溶质更易分离或萃取剂更环保等;
(2)①已知I.CO2(g)+H2(g) = CO(g)+H2O(g) △H= +41kJ/mol
II.2CO2(g)+6H2(g) = C2H4(g)+4H2O(g) △H= -128kJ/mol
根据盖斯定律,II-I![]() 2可得:2CO(g)+4H2(g)= C2H4(g)+2H2O(g) 的 △H=(-128kJ/mol)- (+41kJ/mol)
2可得:2CO(g)+4H2(g)= C2H4(g)+2H2O(g) 的 △H=(-128kJ/mol)- (+41kJ/mol)![]() 2=-210kJ/mol,
2=-210kJ/mol,
则图中CO转化为C2H4的热化学方程式是2CO(g)+4H2(g)= C2H4(g)+2H2O(g) △H= -210kJ/mol;
②a.X与Y是两种烷烃,实验式分别为C5H12和C3H7,明显不同, a项错误; b.分析对称性不难发现,它们的一氯代物都只有4种,b项正确;
c.作为烷烃,均不能使酸性KMnO4溶液褪色,c项错误;
d. X与Y是两种烷烃,分子式分别为C5H12和C6H14,二者互为同系物,d项正确。
答案选bd;
③题目已告知反应的微粒有Fe2+、Fe3+和OH-,生成物有Fe3O4,根据电荷守恒和原子守恒写出离子方程式为Fe2++2Fe3++8OH-=Fe3O4↓+4H2O。
因此,本题正确答案为:2CO(g)+4H2(g)= C2H4(g)+2H2O(g) △H= -210kJ/mol;bd;Fe2++2Fe3++8OH-=Fe3O4↓+4H2O。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____晶体,SeO2中Se原子采取的杂化类型为___。
(二)A、X、Y、Z、W、M、G等原子序数一次增大的前四周期元素
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)画出W基态原子的核外电子排布图______。
(2)A2Y的VSEPR模型名称为____。
(3)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理,写出X2Y的电子式____。
(4)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。
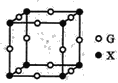
(5)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为_____cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3﹣丁二烯和2﹣丁炔分别与氢气反应的热化学方程式如下:CH2=CH﹣CH=CH2 (g)+2H2 (g)→ CH3CH2CH2CH3 (g) H=-236.6kJ/mol CH3﹣C≡C﹣CH3 (g)+2H2 (g)→ CH3CH2CH2CH3 (g) H=-272.7kJ/mol。由此不能判断 ( )
A. 1,3﹣丁二烯和2﹣丁炔稳定性的相对大小
B. 1,3﹣丁二烯和2﹣丁炔分子储存能量的相对高低
C. 1,3﹣丁二烯和2﹣丁炔相互转化的热效应
D. 一个碳碳叁键的键能与两个碳碳双键的键能之和的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbI2(亮黄色粉末)是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成PbI2的实验流程如图1:
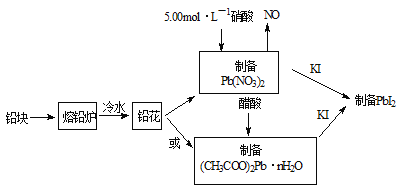

(1)将铅块制成铅花的目的是_____________。
(2)31.05g铅花用5.00mol·L-1的硝酸溶解,至少需消耗5.00 mol·L-1硝酸_______mL。
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中加热,测得样品固体残留率)(![]() )随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb·nH2O中结晶水数目n=__________(填整数)。
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为___________(写分子式)。
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL。则室温时PbI2的Ksp为___________。
(5)探究浓度对磺化铅沉淀溶解平衡的影响。
该化学小组根据所提供试剂设计两个实验,来说明浓度对沉淀溶解平衡的影响。
提供试剂:NaI饱和溶液、NaCl饱和溶液、FeCl3饱和溶液、PbI2饱和溶液、PbI2悬浊液。
信息提示:Pb2+和Cl-能形成较稳定的PbCl42-络离子。
请填写下表的空白处:
实验内容 | 实验方法 | 实验现象及原因分析 |
①磺离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
②铅离子浓度减小对平衡的影响 | ________ | 现象:________ 原因:________ |
③________ | 在PbI2悬浊液中滴入几滴FeCl3饱和溶液 | 现象:黄色浑浊消失 ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上海水淡化的主要方法有蒸馏法、电渗析法、反渗透法等。电渗析法是在直流电源作用下通过离子交换膜对海水进行处理(原理如图所示);反渗透法是利用压强差使海水一侧的水分子通过渗透膜进入淡水一侧,从而得到淡水和浓缩的盐溶液(原理如图所示)。下列说法正确的是
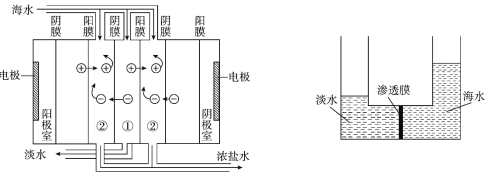
A. 蒸馏法、电渗析法、反渗透法均不发生化学反应
B. 反渗透法所用渗透膜的微孔直径范围是1~100nm
C. 蒸馏法具有设备简单、成本低等优点
D. 浓缩的盐溶液可用于提取或制备食盐、镁、溴等物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锆(Zr)是40号元素,位于第五周期ⅣB族,锆可溶于氢氟酸和王水,锆及其化合物在陶瓷、耐火材料等多个领域有着重要用途。请回答下列相关问题。
(1)基态锆原子的价电子排布图(轨道表示式)是___。
(2)ZrSiO4和ZrSiO3是锆的两种硅酸盐,二者含有的阳离子Zr4+和Zr2+中比较稳定的是____,原因是___。SiO32-的空间构型是____,SiO42-中的Si原子的杂化类型是____。
(3)[Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是___(填元素符号),该离子中含有的化学键种类不包括___(填选项序号)。
A.极性键 B.非极性键 C.σ键 D.π键
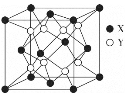
(4)立方氧化锆是一种人工合成的氧化物,由于硬度极高且外观接近钻石常被用作钻石的替代品,其晶胞结构如图所示,立方氧化锆的化学式是___,锆原子的配位数是____。若晶胞中距离最近的两个氧原子间的距离为anm,则立方氧化锆的密度为__g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应过程能量变化如图所示,下列说法正确的是
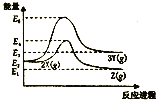
A. 由X→Y反应的ΔH=E2-E3
B. 降低压强有利于提高X→Z的转化率
C. 升高温度有利于提高X→Z的反应速率
D. 由图可知,等物质的量的Y的能量一定比X的能量高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com