
 N2O4(g)可知,NO2的浓度变化是N2O4浓度变化量的2倍,据此判断;
N2O4(g)可知,NO2的浓度变化是N2O4浓度变化量的2倍,据此判断;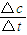 计算v(NO2);
计算v(NO2);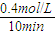 =0.04mol?L-1?min-1,故答案为:0.04mol?L-1?min-1;
=0.04mol?L-1?min-1,故答案为:0.04mol?L-1?min-1;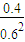 =
=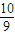 ,故答案为:
,故答案为: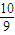 ;
;

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
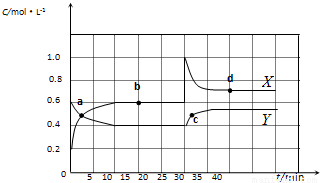
 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图所示.
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图所示.| 10 |
| 9 |
| 10 |
| 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| c(H2)c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
 (2009?宿迁二模)已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
(2009?宿迁二模)已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)(正反应为放热反应).现将一定量NO2 和N2O4 的混合气体通入一体积为1L的恒温密闭容器中,反应物的浓度随时间变化的关系曲线如图所示.请回答下列问题:
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)(正反应为放热反应).现将一定量NO2 和N2O4 的混合气体通入一体积为1L的恒温密闭容器中,反应物的浓度随时间变化的关系曲线如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
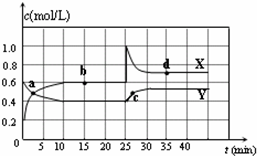 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )| A、图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | B、a、b、c、d四个点中,只有b、d点的化学反应处于平衡状态 | C、25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L | D、前10 min内用v(NO2)表示的化学反应速率为0.06 mol/(L?min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com