
【题目】高铁电池是一种新型可充电电池,能较长时间保持稳定的放电电压。高铁电池放电时总反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
(1)高铁电池的负极材料是______。
(2)放电时,正极发生________(填“氧化”或“还原”)反应。
(3)负极电极反应式为______________,正极电极反应式为______________正极附近溶液的碱性_____(填“增强,减弱,不变”)。
【答案】Zn 还原 Zn-2e-+2OH-=Zn(OH)2 ![]() +3e-+4H2O=Fe(OH)3+5OH- 增强
+3e-+4H2O=Fe(OH)3+5OH- 增强
【解析】
放电时,该电池是原电池,原电池负极上失电子化合价升高而发生氧化反应;正极上得电子发生还原反应,总反应方程式减去负极电极反应式即得正极反应式。
(1)电池的负极上发生氧化反应,正极上发生还原反应。由高铁电池放电时总反应方程式可知,负极材料应为作还原剂的Zn,故答案为:锌;
(2)正极上得电子发生还原反应,故答案为:还原;
(3)负极电极反应式为Zn-2e-+2OH-═Zn(OH)2,由电池的总反应方程式-负极反应式=正极反应式可知,正极反应式为FeO42-+3e-+4H2O═Fe(OH)3+5OH-,正极上生成氢氧根离子导致溶液中氢氧根离子浓度增大,溶液的碱性增强,故答案为:Zn-2e-+2OH-═Zn(OH)2;FeO42-+3e-+4H2O═Fe(OH)3+5OH-;增强。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】六氟化硫分子为正八面体构型(分子结构如图),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是( )
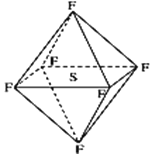
A. SF6分子是含有极性键的非极性分子
B. SF6各原子均达8电子稳定结构
C. SF6易燃烧生成SO2
D. SF6是原子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(分子式为:C2H4)是来自石油的重要有机化工原料,B、D是厨房中的两种有机物,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
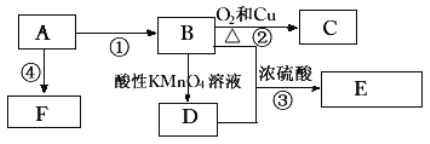
(1)A的电子式为________,官能团为:________;C的名称________,E的分子式为:________。
(2)B分子中的官能团名称是________,D分子中的官能团名称是________.
(3)写出下列反应的化学方程式并指出反应类型:
①________,反应类型________。
②________,反应类型________。
④________,反应类型________。
查看答案和解析>>
科目:高中化学 来源: 题型:
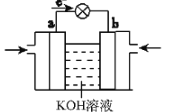
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。回答以下问题:
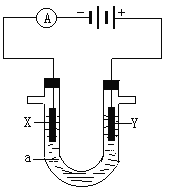
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,在 X极附近观察到的现象是:________________。
(2)Y电极上的电极反应式是_________,检验该电极反应产物的方法是:______________。
(3)如果用电解方法精炼粗铜(粗铜中含有杂质锌和银),电解液a选用CuSO4溶液,则Y 电极的材料是____,电极反应式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萝卜硫素(结构如图)是具有抗癌和美容效果的天然产物之一,在一些十字花科植物中含量较丰富。该物质由五种短周期元素构成,其中W、X、Y、Z的原子序数依次增大,Y、Z原子核外最外层电子数相等。下列叙述一定正确的是( )
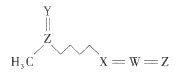
A.原子半径的大小顺序为Z>W>X>Y
B.X的简单氢化物与W的氢化物反应生成离子化合物
C.萝卜硫素中的各元素原子最外层均满足8电子稳定结构
D.Y、Z形成的二元化合物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用SO2和Cl2在活性炭作用下制取SO2C12,原理为SO2(g)+Cl2(g)SO2Cl2(l) H=-97.3kJ/mol。装置如图所示(部分装置已省略)。已知SO2C12的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法正确的是

A.乙中盛放的试剂为无水氯化钙
B.制备过程中需要将装置甲置于冰水浴中
C.用来冷却的水应该从a口入,b口出
D.可用硝酸与亚硫酸钠反应制备二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
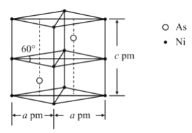
【题目】2018年11月《物理评论快报》报道了艾姆斯实验室制造的包含钙、钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料,呈现出被称为刺猬自旋新磁态。有助于更好理解磁性 与非常规超导性之间的联系。回答下列问题:
(1)基态镍原子的价电子排布式为_______;上述材料中所含元素的基态原子中,未成对电子数最多的是_______ (填元素符号)。
(2)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)x]4-、Fe(CO)5等。所包括的非金属元素中第一电离能最大的是______(填元素符号);[Fe(CN)6] 4-中含有σ键与π键的数目比为_____________。
(3)K3AsO3可用于碘的微量分析。
①AsO33-的立体构型为_______,写出一种与其互为等电子体的分子_______(填化学式)。
②K+的焰色反应呈紫色,金属元素能产生焰色实验的微观原因为_______。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为_______。
(5)①金属镍的原子堆积方式如图所示,则金属镍晶胞俯视图为_______。

a. b.
b. c.
c. d.
d.
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=_____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一 种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物。
(1)W在元素周期表中的位置是______。
(2)2.24L(标准状况)XQ3被200mL 1mol/L QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是______。
(3)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是______。
(4)已知:W(s)+Y2(g)═WY2(g)△H=-393.5kJ/mol WY(g)+ ![]() Y2(g)═WY2(g)△H=-283.0kJ/mol24g W与一定量的Y2反应,放出热量362.5kJ,所得产物的物质的量之比是______。
Y2(g)═WY2(g)△H=-283.0kJ/mol24g W与一定量的Y2反应,放出热量362.5kJ,所得产物的物质的量之比是______。
(5)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com