
9.75g锌与0.3 mol的盐酸刚好完全反应,放出0.15 mol H2,在溶液中有0.15mol Zn2+离子和0.3 mol Cl﹣离子,把反应后的溶液蒸干,可以得到ZnCl20.15 mol.
考点: 物质的量的相关计算.
分析: 发生反应Zn+2HCl=ZnCl2+H2↑,根据n= 计算Zn的物质的量,再根据方程式计算氢气、氯化锌的物质的量,溶液中n(Zn2+)=n(ZnCl2 ),n(Cl﹣)=2n(ZnCl2 ).
计算Zn的物质的量,再根据方程式计算氢气、氯化锌的物质的量,溶液中n(Zn2+)=n(ZnCl2 ),n(Cl﹣)=2n(ZnCl2 ).
解答: 解:9.75gZn的物质的量为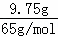 =0.15mol
=0.15mol
Zn+2 HCl=ZnCl2+H2↑
1 2 1 1
0.15mol x y z
所以x=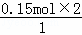 =0.3mol
=0.3mol
y=z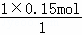 0.15mol
0.15mol
溶液中n(Zn2+)=n(ZnCl2 )=0.15mol,n(Cl﹣)=2n(ZnCl2 )=0.15mol×2=0.3mol,
故答案为:0.3;0.15;0.15;0.3;0.15.
点评: 本题考查化学方程式有关计算,侧重物质的量的计算,比较基础,有利于基础知识的巩固.


科目:高中化学 来源: 题型:
在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g)⇌3C(g)+D(g),达到平衡状态的是()
A. 器内压强不随时间变化而变化
B. 反应器内A、B、C、D物质的量比为1:3:3:1
C. 生成A的速率和生成的D的速率相等
D. 生成 1mol A同时有3 mol C被消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g•cm﹣3,则盐酸的物质的量浓度是()
A. 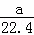 mol•L﹣1 B.
mol•L﹣1 B. 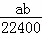 mol•L﹣1
mol•L﹣1
C. 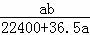 mol•L﹣1 D.
mol•L﹣1 D. 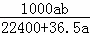 mol•L﹣1
mol•L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
某盐的溶液中含有Na+、Mg2+、Cl﹣、SO42﹣四种离子,若Na+为0.2mol,Mg2+为0.4mol,Cl﹣为0.4mol,则SO42﹣物质的量为()
A. 0.1mol B. 0.3mol C. 0.5mol D. 0.15mol
查看答案和解析>>
科目:高中化学 来源: 题型:
用18mol•L﹣1 浓硫酸配制100mL 3.0mol•L﹣1 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸 ③溶解④转移、洗涤⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (从下列中选用A.10mLB.25mLC.50mLD.100mL).
(2)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中少量杂质的方法不正确的是()
A. 除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
B. 除去CO2中混有的HCl:用饱和NaHCO3溶液洗气
C. 除去BaCO3固体中混有的BaSO4:加入过量的盐酸、过滤、洗涤
D. 除去甲烷中混有的乙炔:通过溴水溶液后,洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈.发生的反应体系中共有六种物质:NH4C1、FeC13、N2、Fe2O3、Fe 和X.
(1)根据题意,可判断出X是 (写化学式).
(2)写出并配平该反应的化学方程式:
(3)发生氧化反应的物质是 ,反应中4mol的氧化剂能 (填“失去”或“得到”) mol电子.
(4)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应热的说法正确的是()
A. 当△H为“﹣”时,表示该反应为吸热反应
B. 已知C(s)+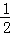 O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
C. 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D. 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com