
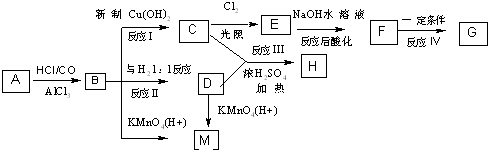
 、M
、M ;
; ;C+D→H:
;C+D→H: .
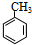
.分析 化合物B的分子式为C8H8O,当以铁做催化剂进行氯化时,一元取代物只有两种,根据题给信息知,A分子中含有7个碳原子,含有苯环,结构简式为 ,B苯环上一元取代物有两种,则B结构简式为
,B苯环上一元取代物有两种,则B结构简式为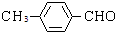 ,B与新制氢氧化铜悬浊液发生氧化反应生成C,C为
,B与新制氢氧化铜悬浊液发生氧化反应生成C,C为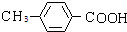 ,B与氢气1:1发生加成反应生成D,则D为
,B与氢气1:1发生加成反应生成D,则D为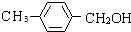 ,B被酸性高锰酸钾氧化生成M,D氧化也生成M,结合反应信息可知,M为
,B被酸性高锰酸钾氧化生成M,D氧化也生成M,结合反应信息可知,M为 .C与D在浓硫酸、加热条件下发生酯化反应生成H,则H为
.C与D在浓硫酸、加热条件下发生酯化反应生成H,则H为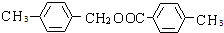 .
.
C光照发生甲基中取代反应生成E,E在氢氧化钠水溶液、加热条件发生水解反应,并酸化生成F,F生成G为高分子化合物,则F中含有-OH、-COOH,则C发生一氯取代生成E,则E为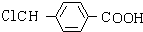 ,故F为
,故F为 ,F发生缩聚反应生成G,则G为
,F发生缩聚反应生成G,则G为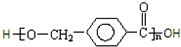 ,据此分析解答.
,据此分析解答.
解答 解:化合物B的分子式为C8H8O,当以铁做催化剂进行氯化时,一元取代物只有两种,根据题给信息知,A分子中含有7个碳原子,含有苯环,结构简式为 ,B苯环上一元取代物有两种,则B结构简式为
,B苯环上一元取代物有两种,则B结构简式为 ,B与新制氢氧化铜悬浊液发生氧化反应生成C,C为
,B与新制氢氧化铜悬浊液发生氧化反应生成C,C为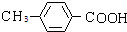 ,B与氢气1:1发生加成反应生成D,则D为
,B与氢气1:1发生加成反应生成D,则D为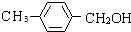 ,B被酸性高锰酸钾氧化生成M,D氧化也生成M,结合反应信息可知,M为
,B被酸性高锰酸钾氧化生成M,D氧化也生成M,结合反应信息可知,M为 .C与D在浓硫酸、加热条件下发生酯化反应生成H,则H为
.C与D在浓硫酸、加热条件下发生酯化反应生成H,则H为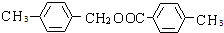 .
.
C光照发生甲基中取代反应生成E,E在氢氧化钠水溶液、加热条件发生水解反应,并酸化生成F,F生成G为高分子化合物,则F中含有-OH、-COOH,则C发生一氯取代生成E,则E为 ,故F为
,故F为 ,F发生缩聚反应生成G,则G为
,F发生缩聚反应生成G,则G为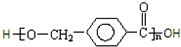 ,
,
(1)结构简式:A为 、M为
、M为 ,故答案为:
,故答案为: ;
; ;
;
(2)通过以上分析知,I氧化反应、Ⅳ为缩聚反应,
故答案为:氧化反应;缩聚反应;
(3)B→C反应方程式为: ;
;
C+D→H反应方程式为: 故答案为:
故答案为: ;
; ;
;
(4)C(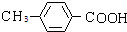 )的同分异构体且属于酯类的芳香族化合物的同分异构体的结构简式有:
)的同分异构体且属于酯类的芳香族化合物的同分异构体的结构简式有: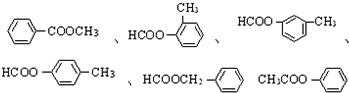 ,共有6种,
,共有6种,
(5)C为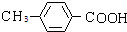 ,与C互为同分异构体且能发生银镜反应说明含有醛基;遇FeCl3溶液显紫色说明含有酚羟基;含甲基的芳香族的化合物说明含有甲基和苯环,
,与C互为同分异构体且能发生银镜反应说明含有醛基;遇FeCl3溶液显紫色说明含有酚羟基;含甲基的芳香族的化合物说明含有甲基和苯环,
如果-CHO、-OH位于邻位,则有4种同分异构体;
如果-CHO、-OH位于间位,有4种同分异构体;
如果-CHO、-OH位于对位,有2种同分异构体,所以符合条件的有10种,
故答案为:10.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识迁移能力,正确判断AB结构是解本题关键,再利用题给信息结合反应条件推断即可,难点是同分异构体种类判断,题目难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
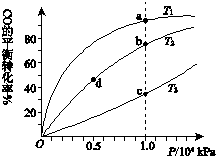 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A.温度: | T1>T2>T3 | |
| B.正反应速率: | υ(a)>υ(c) | υ(b)>υ(d) |
| C.平衡常数: | K(a)>K(c) | K(b)=K(d) |
| D.平均摩尔质量: | M(a)<M(c) | M(b)>M(d) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去铜器表面的铜绿[Cu2(OH)2CO3]:用硝酸浸泡,再用清水冲洗 | |
| B. | 除去K2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去KNO3晶体中少量NaCl:加水溶解、蒸发浓缩、冷却结晶、过滤洗涤 | |
| D. | 除去Mg(OH)2中少量的Ca(OH)2:加水,通入CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4mol | B. | 6mol | C. | 8mol | D. | 10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与CO2反应产生1molO2,转移的电子数为4NA | |
| B. | 22.4LN2和NH3混合气体中原子间一定存在3NA个共用电子对 | |
| C. | 将0.1mol氯化铁溶于1 L水中,所得溶液含有0.1NAFe3+ | |
| D. | 2molSO2和1molO2混合,在V2O5存在的条件下在密闭容器中加热反应后,容器内物质分子数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3是极性分子,N原子处在3个H原子所组成的三角形的中心 | |
| B. | CCl4性是非极性分子,C原子处在4个Cl原子所组成的正方形的中心 | |
| C. | H2O是极性分子,O原子不处在2个H原子所连成的直线的中央 | |
| D. | CO2是非极性分子,C原子不处在2个O原子所连成的直线的中央 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛和甲酸都能发生银镜反应 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 苯酚与溴水直接就可反应,而苯与溴反应则需要加铁屑 | |
| D. | 苯酚和乙酸都可以与氢氧化钠反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
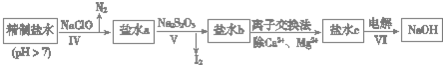
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com