
I�������仯�����ڹ�ũҵ������������������ҪӦ�ã����ٵ����������ڴ����е��ŷ��ǻ�����������Ҫ����֮һ��
(1)��֪��2NO(g) = N2(g)+O2(g) ��H=��180.5kJ•mol��¹
C(s)+O2(g)=CO2(g) ��H=��393.5 kJ•mol ��¹
��¹
2C(s)+O 2(g)=2CO(g) ��H=��221kJ•mol��¹
��ij��Ӧ��ƽ�ⳣ������ʽΪ�� ����д���˷�Ӧ���Ȼ�ѧ����ʽ ��
����д���˷�Ӧ���Ȼ�ѧ����ʽ ��
(2)N2O5��һ�������¿ɷ����֡�������
2N2O5(g)��4NO2(g)��O2(g)��ij�¶��²�ú����ܱ��� ����N2O5Ũ����ʱ��ı仯���±���
����N2O5Ũ����ʱ��ı仯���±���
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/(mol•L��1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
��2.00min~5.00 min�ڣ�NO2��ƽ����Ӧ����Ϊ ����֪��������ʵ�������ϵѹǿ�����ȣ�����Ӧ��ʼʱ��ϵѹǿΪP0����4.00 minʱ��ϵѹǿΪP1����P1�� P0�� ��
P0�� ��
��һ���¶��£��ں����ܱ������г���һ����N2O5���и÷�Ӧ�����жϷ�Ӧ�Ѵﵽ��ѧƽ��״̬���� ��
a��������ѹǿ���ٱ仯 b��NO2��O2������ȱ��ֲ���
c��2����(NO2)������(N2O5) d��������ܶȱ��ֲ���
II��˫��ˮ��һ����Ҫ����ɫ�Լ�����ҵ�Ͽɲ�ȡ����ϡŨ�ȵ���������ȡ˫��ˮ(H2O2ֻΪ��ԭ����)������Ļ�ѧ����ʽΪ��3H2O+3O2  O3+3H2O2���������ĵ缫��ӦʽΪ �������ĵ缫��ӦʽΪ ��
O3+3H2O2���������ĵ缫��ӦʽΪ �������ĵ缫��ӦʽΪ ��
 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������б������߶�11��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ���¶��£�һ������ʯ��������Һ�д�������ƽ�⣺Ca(OH)2(s)  Ca(OH)2(aq)
Ca(OH)2(aq)  Ca2+(aq)+2OH-(aq),���������Һ�м���������ʯ��ʱ������˵������ȷ����
Ca2+(aq)+2OH-(aq),���������Һ�м���������ʯ��ʱ������˵������ȷ����
A��n (Ca2+)���� B��c(Ca2+)����
C��c(OH-)���� D��n(OH-)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����¿��Դ����Ӧ�Կ��Ի�ѧ���������棩 ���ͣ�ѡ����
��0.5 mol/LNa2CO3��Һ��a mol/L NaHCO3��Һ�������ϣ�������Һ������Ũ�ȼ�Ĺ�ϵ������ж���ȷ����
A��c��Na+����2c��CO32-��+c��HCO3-��+c��OH-��
B��c��Na+��=c��CO32-��+c��HCO3-��+c��H2CO3��
C����c��Na+����c��HCO3-����c��CO32-����c��OH-����c��H+������һ��a>0.5
D����c��CO32-��+2c��OH-��=2c��H+��+c��HCO3-��+3c��H2CO3�������ȷ��a=0.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ�����ϵ����νβ⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ��Ƽ�����ᡢ����������أ�����˵������ȷ����
A����ȩ��ˮ��Һ����ɱ�������������ã������ڱ��涯��걾
B�����ع��͡���ֹʳ�ã������������Ʒ������������
C������������ʳƷʱʹ�ý϶������������ƣ���ʹʳƷ�ϳ�ʱ�䱣�ֺ���
D�����˻��в��õ���������Ƴ̳����Խ��� PM2.5 ���ŷţ���С������Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ���������ݸ�������12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ָ����Ӧ�����ӷ���ʽ��ȷ����
A��BaSO3��ϡHNO3��Ӧ��BaSO3+2H+=Ba2��+SO2��+H2O
B��Ca(OH)2��Һ�����NaHCO3��Һ��Ӧ��HCO3��+Ca2��+OH��=CaCO3��+H2O
C��������Һ��KIO3��KI��Ӧ����I2��IO 3����I����6H��=I2��3H2O
3����I����6H��=I2��3H2O
D����CuSO4 ��Һ�м���Na2O2��2Na2O2+2Cu2++2H2O=4
��Һ�м���Na2O2��2Na2O2+2Cu2++2H2O=4 Na++2Cu(OH)2��+O2��
Na++2Cu(OH)2��+O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����и���������12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA�ǰ����ӵ�������ֵ������˵����ȷ����
A��7g����ʽΪCnH2n�������к��е�C��H������ĿΪNA
B����״���£�2.24 L CHCl3�����й��ۼ�����ĿΪ0.4NA
C��һ���¶��£�l L l mol��L-1��CH3COONa��Һ��NA��CH3COO������
D��1 mol SO2������O2��һ�������·�Ӧ����SO3����ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡ������ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ʵ����
����һ������ɫ����,��ѧ�����ȶ�����+2��+3��+6��Ϊ������̬����ҵ���Ը�������Ҫ�ɷ�ΪFeO��Cr2O3������Al2O3��SiO2�����ʣ�Ϊ��Ҫԭ���������������ظ����ƣ�Na2Cr2O7��2H2O��������Ҫ�����������£�
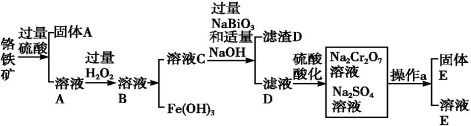
��֪����Na2Cr2O7��һ��ǿ������
�ڳ����£�NaBiO3������ˮ����ǿ�����ԣ��ڼ��������£��ܽ�Cr3+ת��ΪCrO42��
�Ź�ҵ�ϳ������Ȼ�ԭ���Ʊ���������д����Cr2O3Ϊԭ�ϣ��������ȷ�Ӧ��ȡ�������Ļ�ѧ����ʽ�� ��
���ữ��ҺDʱ����ѡ�������ԭ���� ��
�ǹ���E����Ҫ�ɷ���Na2SO4��������ͼ��������aΪ ��
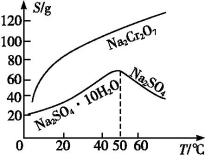
����֪��+6�۸�����ˮ����Ⱦ��������Ƴ������Ķ�ͭ��ˮ����������һ������Cr2O72���������÷�ˮ���û�ԭ�������������������£�

��Cr(OH)3�Ļ�ѧ������Al(OH)3���ơ����������������м���NaOH��ҺʱҪ������Һ��pH���ܹ��ߣ�����Ϊ ��
��������Һ�п��Դ�������������Na2S2O3��Һ���� ����ѡ����ţ�
A��FeSO4��Һ B��ŨH2SO4 C������KMnO4��Һ D��Na2SO3��Һ
�����������У�ÿ����0.1molNa2S2O3ת��0.8mole���������Na2S2O3��Һʱ������Ӧ�����ӷ���ʽΪ ��
�ɸ����йع��ұ�����CrO42���ķ�ˮҪ����ѧ������ʹ��Ũ�Ƚ���5.0��10��7mol��L��1���²����ŷš������·���������ˮ����������Ա�������BaCrO4����[Ksp(BaCrO4)��1.2��10��10]���ټ�������������δ��������Ba2+�����������Ա��κ�ķ�ˮ��Ba2+��Ũ��Ӧ��С�� mol��L��1����ˮ�������ܴﵽ�����ŷű���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶����¿��廯ѧ���������棩 ���ͣ�ѡ����
���й����������ʱ仯�ıȽϣ�����ȷ����
A. �ȶ��ԣ�HI��HBr��HCl��HF B. ԭ�Ӱ뾶��С��Na��S��O
C. ����ǿ����KOH��NaOH��LiOH D. ��ԭ��ǿ����Cl����Br����I��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ�߶�12���¿���ѧ���������棩 ���ͣ�ѡ����
����˵����ȷ����
A���ϳ�����Ĺ�ҵβ������ֱ���������
B������Ӵ��ҵ����壬�����Ⱦ�����������
C���ӷ���¯���ų���¯��������Ϊ����
D���ڸ��¡���ѹ����SO2��O2�ϳ�SO3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com