
【题目】根据题意填空
(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH=;可以使0.10molL﹣1 CH3COOH的电离程度增大的是
a.加入少量0.10molL﹣1的稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010molL﹣1 d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10molL﹣1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)V(醋酸)(填“>”、“<”或“=”).
(3)0.1mol/L的某酸H2A的pH=4,则H2A的电离方程式为
(4)25℃时,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=6,则NaOH溶液与盐酸溶液的体积比为 .
【答案】
(1)3;bcf
(2)<
(3)H2A?H++HA﹣ , HA﹣?H++A2﹣
(4)10:1
【解析】解:(1)0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,溶液中氢离子浓度为0.1mol/L×1%=0.001mol/L,则溶液PH=3; a.加入少量0.10molL﹣1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误; b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确; c.加水稀释至0.010molL﹣1 , 促进醋酸的电离,则醋酸的电离程度增大,故正确; d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误; e.加入少量氯化钠固体,不影响平衡的移动,则不改变醋酸的电离,故错误; f.加入少量0.10molL﹣1的NaOH溶液,氢氧根离子和氢离子反应生成水,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故正确;所以答案是:3; bcf;(2)醋酸是弱酸,随着它和金属的反应,电离平衡不断地向右移动,会电离出更多的氢离子,所以醋酸产生的氢气体积较大;所以答案是:<;(3)常温下,0.1mol/L的某酸H2A的pH=4,说明该酸部分电离,则为弱酸,H2A是二元弱酸,分步电离,电离方程式为:H2AH++HA﹣ , HA﹣H++A2﹣;所以答案是:H2AH++HA﹣ , HA﹣H++A2﹣;(4)25℃时所得混合溶液的pH=6,溶液呈酸性,则c(H+)= ![]() =10﹣6 , 所以V(HCl):V(NaOH)=10:1;所以答案是:10:1.
=10﹣6 , 所以V(HCl):V(NaOH)=10:1;所以答案是:10:1.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用.电解质溶液为KOH溶液,电池反应为:Cd+2NiO(OH)+2H2O ![]() Cd(OH)2+2Ni(OH)2 , 下列有关镍镉电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2 , 下列有关镍镉电池的说法正确的是( )
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应为Cd(OH)2+2e﹣═Cd+2OH ﹣
C.放电时电池内部OH﹣向正极移动
D.充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法正确的是( )
A.将饱和硫酸铜溶液降温,析出的固体不是晶体
B.假宝石往往是玻璃仿造的,可以用划痕的方法鉴别宝石和玻璃制品
C.石蜡和玻璃都是非晶体,但它们都有固定的熔点
D.蓝宝石在不同方向上的硬度一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2与N2O4相互转化:2NO2(g)N2O4(g);△H=﹣24.2kJ/mol 在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图.下列推理分析合理的是( )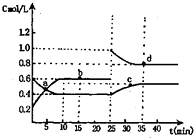
A.a,b,c,d四点中c正与v逆均相等
B.反应进行到10min时,体系吸收的热量为9.68kJ
C.前10min内,用v(NO2)表示的该反应速率为0.02mol/Lmin
D.25min时,导致平衡移动的原因是升温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列说法中正确的是( )
A.标准状况下,22.4L酒精中含有的分子数目为NA
B.常温常压下,1.0mol/L盐酸中含有的氯离子数目为NA
C.常温常压下,24gO2和24gO3含有的氧原子数目都为1.5NA
D.标准状况下,2.24L氯气与足量NaOH溶液反应转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁和稀硫酸制氢气,不能加快氢气生成速率的措施是
A. 用等质量的铁粉代替铁片B. 用98%浓硫酸代替稀硫酸
C. 在稀硫酸中滴加少量CuSO4溶液D. 溶液加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关杂化轨道的叙述错误的是 ( )
A.并不是所有的原子轨道都参与杂化
B.同一个原子中能量相近的原子轨道参与杂化
C.杂化轨道能量集中,有利于牢固成键
D.杂化轨道中一定有电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com