
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Fe3+、Mg2+、SO42-、NO3- |
| B、Ag+、Al3+、NO3-、OH- |
| C、Na+、Ba2+,Cl-、ClO- |
| D、K+、Na+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
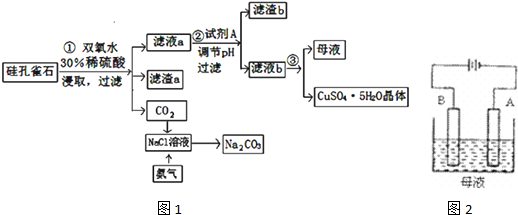
查看答案和解析>>
科目:高中化学 来源: 题型:
 微型化学实验可以有效实现化学实验绿色化的要求.如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.
微型化学实验可以有效实现化学实验绿色化的要求.如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.乙炔与与氯化氢反应制取氯乙烯 |
| B、乙烷和氯气反应制取氯乙烷 |
| C、.乙烯与氢气反应制取乙烷 |
| D、.乙烯通入溴水,溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质一定是离子化合物,弱电解质一定是共价化合物 |
| B、强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 |
| C、CO2的水溶液导电能力很弱,所以CO2是弱电解质 |
| D、属于共价化合物的电解质在熔化状态下一般不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(SO2):n(O2)=2:1 |
| B、反应达到平衡后,缩小容器体积,正反应速率加快,逆反应速率减慢,平衡正向移动 |
| C、反应达到平衡时,加入催化剂,速率加快,平衡常数增大 |
| D、当v正(SO2):v正(SO3)=1:1时,说明该化学反应已经达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
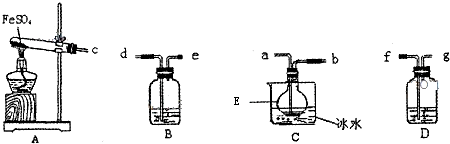
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com