
【题目】乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):

请回答下列问题:
(1)A的化学名称是____;
(2)B和A反应生成C的化学方程式为________,该反应的类型为________;
(3)D的结构简式为________;
(4)F的结构简式为________;
(5)D的同分异构体D1能发生银镜反应,则D1的结构简式为________。
【答案】乙醇 CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 + H2O 取代(酯化)反应
CH3COOCH2CH3 + H2O 取代(酯化)反应 ![]() CH3COOCH2CH2OOCCH3 CH3CHO
CH3COOCH2CH2OOCCH3 CH3CHO
【解析】
乙烯与水发生加成反应生成的A为乙醇,乙醇发生氧化生成B,B与乙醇在浓硫酸、加热条件下发生反应生成C,结合C的分子式可知,B为CH3COOH,C为CH3COOCH2CH3;乙烯与氧气催化氧化生成D,结合D的分子式,D为环氧乙烷,D与水反应生成E,E能与乙酸在浓硫酸、加热条件下发生反应生成F,结合F的分子式推知,E为HOCH2CH2OH,F为CH3COOCH2CH2OOCCH3;据此解答。
乙烯与水发生加成反应生成的A为乙醇,乙醇发生氧化生成B,B与乙醇在浓硫酸、加热条件下发生反应生成C,结合C的分子式可知,B为CH3COOH,C为CH3COOCH2CH3;乙烯与氧气催化氧化生成D,结合D的分子式,D为环氧乙烷,D与水反应生成E,E能与乙酸在浓硫酸、加热条件下发生反应生成F,结合F的分子式推知,E为HOCH2CH2OH,F为CH3COOCH2CH2OOCCH3。
(1)乙烯与水发生加成生成的A为乙醇,A的化学名称为乙醇;
(2)乙醇和乙酸发生酯化反应生成乙酸乙酯,方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,反应类型为取代(酯化)反应;
CH3COOCH2CH3+H2O,反应类型为取代(酯化)反应;
(3)乙烯与氧气催化氧化生成D,结合D的分子式,D为环氧乙烷,结构简式为![]() ;
;
(4)F为二乙酸乙二酯,结构简式为CH3COOCH2CH2OOCCH3;
(5)D的同分异构体D1能发生银镜反应,D1中含醛基,则D1的结构简式为:CH3CHO。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】组成糖原和核酸的化学元素分别是
A. C H O N和C H O N P S
B. C H O和C H O N P
C. C H O P和C H O N S
D. C H O S和C H O N S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
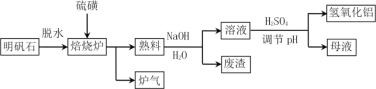
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S ![]() 2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
(2)将标况下1.12L炉气通入100mL 0.5mol·L-1 NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为___________________________________。
(3)熟料溶解时反应的离子方程式为_________________________。
(4)母液中溶质主要成分的化学式为____________、_____________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.8 mol·L-1·s-1
B. 在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
C. 分别用B、C、D表示反应的速率,其比值是3∶2∶1
D. 在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为_____(填字母)nm。
A.435 B500 C.580 D.605 E. 700
(2)元素S和Ca中,第一电离能较大的是_____(填元素符号),其基态原子核外电子排布式为_______。
(3)X射线衍射测定等发现,石膏(CaSO4 2H2O)中存在SO42-离子。SO42-离子的几何构型为_____,中心原子的杂化形式为________。
(4) 基态Ca原子中,核外电子占据最高能层的符号是____,占据该能层电子的电子云轮廓图形状为_____。钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金展锰低,原因是_________________。
(5)过氧化钙晶体的晶胞结构如图所示,已知该晶胞的密度是ρ g cm-3,则晶胞结构中最近的两个Ca2+间的距离为______ (列算式即可,用NA表示阿伏加德罗常数的数值)nm,与Ca2+紧邻O22-的个数为______。
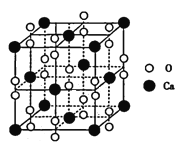
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中进行如下反应:
A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。
3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。
计算:
(1)5 min末A的物质的量浓度为____________________________________________。
(2)5 min内用B表示的化学反应速率v(B)为__________________________________。
(3)化学方程式中n值为___________________________________________________。
(4)此反应在四种不同情况下的反应速率分别为
①v(A)=5 mol·L-1·min-1
②v(B)=6 mol·L-1·min-1
③v(C)=4.5 mol·L-1·min-1
④v(D)=8 mol·L-1·min-1
其中反应速率最快的是______________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:a X(g)+b Y(g) ![]() c Z(g) +d W(g) 反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述不正确的是
c Z(g) +d W(g) 反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述不正确的是
A. 平衡向逆反应方向移动 B. (a+b)>(c+d)
C. Z的物质的量变小 D. X的转化率变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将金属钠置于空气中的加热,可以观察到有淡黄色固体生成,试写出该物质的电子式:___;如金属钠中混有少量金属钾,如何鉴别钾元素的存在?试简述实验操作及对应现象 ______________;
(2)在实验室模拟侯氏制碱法制备碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。该过程的化学方程式为:_____________。
(3)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置可以是_____________。

(4)某实验小组通过下列实验探究过氧化钠与水的反应:

①用化学方程式解释使酚酞试液变红的原因_________,依据实验现象推测红色褪去的原因是_________。
②加入MnO2反应的化学方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com