
| A. | Na+、SO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、K+ | B. | Na+、Cu2+、Br-、Ba2+ | ||
| C. | K+、MnO${\;}_{4}^{-}$、NO${\;}_{3}^{-}$、Na+ | D. | K+、Ca2+、SO${\;}_{3}^{2-}$、Cl- |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 5种 | C. | 4种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
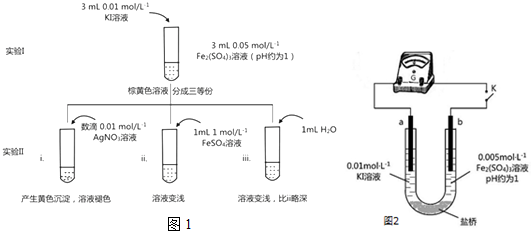
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
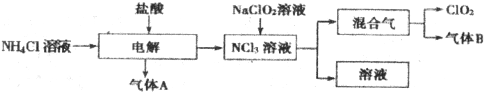
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑥ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18gH2O中含有的原子总数为3NA | |
| B. | 在标准状况下,22.4L Cl2完全溶于水转移的电子数目的为NA | |
| C. | 1L 0.1 mol•L-1 NaHCO3溶液中含有0.1NA个HCO3- | |
| D. | 常温下,pH=7的NaCl溶液中含有的OH-数目为10-7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 由上述原理可推知H2的燃烧热为241.9 kJ/mol | |
| C. | 反应②中的能量变化可用图表示: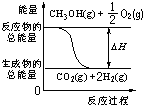 | |
| D. | CH3OH转变成H2的过程一定要吸收能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com