
【题目】CH4-CO2催化重整不仅可以得到合成气CO和H2,还对温室气体的减排具有重要意义。
已知:C(s)+2H2(g)=CH4(g) △H1 K1 C(s)+O2(g) =CO2(g) △H2 K2 ;C(s)+![]() O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
A. △H=2△H3-2△H2-△H1
B. K=2K3-K2-K1
C. 若平衡时c(CH4):c(CO2):c(CO):c(H2)=1:1:1:1,则K一定等于1(mol/L)2
D. 减小压强可增大CH4(g)和CO2(g)的平衡转化率
【答案】D
【解析】
A.①C(s)+2H2(g)=CH4(g) △H1 ②C(s)+O2(g) =CO2(g) △H2 ③C(s)+![]() O2(g) =CO(g) △H3 将方程式2×③-①-②可得CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=2△H3-△H1-△H2,A错误;
O2(g) =CO(g) △H3 将方程式2×③-①-②可得CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=2△H3-△H1-△H2,A错误;
B.根据化学平衡常数的含义可得K1=![]() ;K2=
;K2=![]() ;K3=
;K3=![]() ;K=
;K=![]() ,B错误;
,B错误;
C.若平衡时c(CH4):c(CO2):c(CO):c(H2)=1:1:1:1,假设每种物质的浓度都是x,则K=![]() =
=![]() ,若x=1,则K=1,若x=2,则K=4,所以K不一定为1(mol/L)2,C错误;
,若x=1,则K=1,若x=2,则K=4,所以K不一定为1(mol/L)2,C错误;
D.由于反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的正反应为气体体积增大的反应,所以根据平衡移动原理,减小压强,化学平衡正向移动,从而可增大CH4(g)和CO2(g)的平衡转化率,D正确;
故合理选项是D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
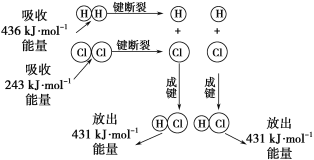
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业合成氨的原理是N2(g)+3H2(g)![]() 2NH3(g) △H=-93.0kJ·mol-1
2NH3(g) △H=-93.0kJ·mol-1
(1)已知一定条件下:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) △H=+l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为___。
4NH3(g)+3O2(g) △H=+l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为___。
(2)如图,在恒温恒容装置中进行合成氨反应。

①表示N2浓度变化的曲线是____。
②前25min内,用H2浓度变化表示的化学反应速率是____。
③在25min末刚好平衡,则平衡常数K=____。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是___。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应①:4NH3(g)+6NO(l)![]() 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)![]() 5N2O(g)+3H2O(g)△H>0。平衡混合气中N2与N2O含量与温度的关系如图。
5N2O(g)+3H2O(g)△H>0。平衡混合气中N2与N2O含量与温度的关系如图。

请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是___,导致这种规律的原因是___(任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3(g)+3O2=2N2+6H2O。则负极电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
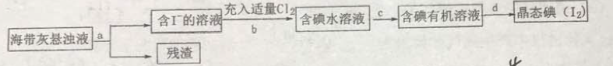
(1)指出提取碘的过程中有关的实验操作名称:a__________,c__________。
(2)操作c需要的仪器是__________,所用的有机试剂可以是CCl4,简述选择理由__________;最后碘的CCl4溶液是通过__________获得(填“漏斗上口”或“漏斗下口”)。
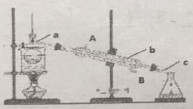
(3)从含碘的有机溶液中提取碘和回收有机溶液CCl4,还需要经过__________,观察下图所示实验装置,指出仪器名称b__________,冷却水从__________进入(填A或B),最后碘留在__________里。(填仪器名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2NO2(g)![]() N2 O4(g);△H= -57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
N2 O4(g);△H= -57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
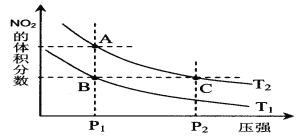
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A浅,C深
C.由状态A到状态B,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某饱和氯化钠溶液的体积为V mL,密度为ρ gmL﹣1,质量分数为w,物质的量浓度为c molL﹣1,溶液中所含NaCl的质量为m g.下列选项正确的是
A.该温度下NaCl的溶解度S=![]() g
g
B.溶液中溶质的物质的量浓度c(NaCl)=![]() molL﹣1
molL﹣1
C.溶液中溶质的物质的量浓度c(NaCl)= ![]() molL﹣1
molL﹣1
D.溶液中溶质的质量分数w=![]() %
%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①AgCl②铜③液态醋酸④CO2⑤H2SO4⑥Ba(OH)2固体⑦NaHCO3⑧稀硝酸⑨熔融FeCl3 ⑩NaHSO4
(1)上述状态下可导电的是_________;(填序号,下同)属于强电解质的是________;属于非电解质的是______.
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为_______________________________
(3)用⑨的饱和溶液制备Fe(OH)3胶体的离子方程式_______________________ 足量的④通入⑥的溶液中的离子方程式______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,X与Y位于不同周期,X与W位于同一主族;原子最外层电子数之比N(Y):N(Q)=3:4;Z的原子序数等于Y、W、Q三种元素原子的最外层电子数之和。请回答下列问题:
(1)Y元素在周期表中的位置是______________;QX4的电子式为_____________。
(2)一种名为“PowerTrekk”的新型充电器是以化合物W2Q和X2Z为原料设计的,这两种化合物相遇会反应生成W2QZ3和气体X2,利用气体X2组成原电池提供能量。
①写出W2Q和X2Z反应的化学方程式:______________。
②以稀硫酸为电解质溶液,向两极分别通入气体X2和Z2可形成原电池,其中通入气体X2的一极是_______(填“正极”或“负极”)。
③若外电路有3mol电子转移,则理论上需要W2Q的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池的装置如图所示,总反应为 H2(g)+HgO(s)=H2O(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过。下列说法正确的是( )

A.正极反应为:HgO(s)2e+H2O=Hg(l)+2OH
B.OH-通过离子交换膜从负极向正极移动,保持溶液中电荷平衡
C.每反应2.24L氢气,交换膜通过0.2mol离子
D.放电结束后,溶液的碱性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com