
| A. | 金属钠高温还原CO2,制人工金刚石膜或粉 | |
| B. | 汽车气囊中用氧化铁除去NaN3受撞击时分解生成的钠 | |
| C. | 隔绝空气条件下加热金属钠与NaNO2反应制取Na2O | |
| D. | 将4.6 g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热 |
分析 A.二氧化碳与过氧化钠反应;
B.氧化铁的氧化性小于过氧化钠;
C.过氧化钠具有强氧化性,可氧化NaNO2;
D.在加热过程中,钠可与空气中氧气反应生成过氧化钠.
解答 解:A.金属钠高温还原CO2,因二氧化碳与过氧化钠反应,则不可能合成过氧化钠,故A错误;
B.因氧化铁的氧化性小于过氧化钠,氧化铁与钠反应只能生成氧化钠,故B错误;
C.过氧化钠具有强氧化性,可氧化NaNO2,则钠与NaNO2反应不可能生成Na2O2,故C错误;
D.在加热过程中,钠可与空气中氧气反应生成过氧化钠,故D正确.
故选D.
点评 本题综合考查过氧化钠知识,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,答题时考虑把握氧化性的强弱比较,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | H | F | I | ||||
| 3 | A | C | D | G | R | |||
| 4 | B |
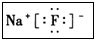 .并用电子式表示该化合物的形成过程_
.并用电子式表示该化合物的形成过程_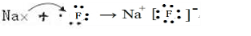
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温、常压下,11.2 L N2含有的分子数为0.5NA | |
| B. | 常温常压下,1mol氦气含有的原子数为NA | |
| C. | 71gCl2所含原子数为2NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含分子数和原子数都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
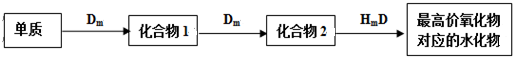
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为1.5NA | |
| C. | 28 g晶体硅中含有Si-Si键的个数为4NA | |
| D. | 60 g SiO2中含Si-O键的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
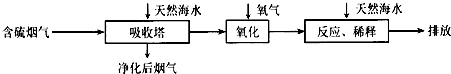
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com