
| A. | 该反应的焓变为负值 | |
| B. | 2CO2(g)+2H2(g)?2CO(g)+2H2O(g)的平衡常数K1=K2 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 | |
| D. | 若恒容、恒温下充入CO,则K值变大 |
分析 衡常数指可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,平衡常数k=$\frac{c(CO)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c(H{\;}_{2})}$,所以该反应化学方程式应为CO2+H2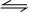 CO+H2O,恒容时,温度升高,H2 浓度减小,平衡向正反应移动,则该反应为吸热反应,以此来解答.
CO+H2O,恒容时,温度升高,H2 浓度减小,平衡向正反应移动,则该反应为吸热反应,以此来解答.
解答 解:A、恒容时,温度升高,H2浓度减小,则该反应为吸热反应,所以△H>0,故A错误;
B、由平衡常数可知,该反应为CO2+H2 CO+H2O,所以2CO2(g)+2H2(g)?2CO(g)+2H2O(g)的平衡常数K1=K2,故B正确;
CO+H2O,所以2CO2(g)+2H2(g)?2CO(g)+2H2O(g)的平衡常数K1=K2,故B正确;
C、升高温度,正、逆反应速率都增大,正反应速率增大更多,平衡正向移动,故C错误;
D、平衡常数仅与温度有关,所以恒容、恒温下充入CO,则K值不变,故D错误.
故选B.
点评 本题考查化学平衡常数、影响化学平衡的因素等,难度中等,注意对化学平衡常数的理解,同一反应化学计量数不同平衡常数不同.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-O-Cl | |
| B. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| C. | CH2F2的电子式: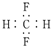 | |
| D. | Cl-的结构示意图: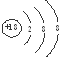 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直接用酒精灯的外焰加热蒸发皿 | |
| B. | 加热过程中不断用玻璃棒搅拌 | |
| C. | 加热到液体全部消失 | |
| D. | 蒸发皿中出现多量晶体、少量液体时,停止加热,利用蒸发皿的余热烘干 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中最多有4种离子 | B. | 若溶液有颜色,则一定没有OH-、I- | ||
| C. | 若溶液呈碱性,则一定含有Na+ | D. | 该溶液不可能溶解单质铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质在溶液中完全电离,其水溶液中不存在分子 | |
| B. | 同一弱电解质溶液,温度不同时,导电能力不同 | |
| C. | 强电解质溶液导电能力不一定比弱电解质溶液的导电能力强 | |
| D. | 强电解质在液态时不一定会导电,但在固态时一定不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 31 | B. | 62 | C. | 222 | D. | 142 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com