
�����ճ���������;��㡢�������Ľ������ϡ�
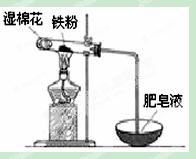 ��1�������£�������������ʢװŨ�����ԭ���� ��
��1�������£�������������ʢװŨ�����ԭ���� ��
��2��ijʵ��С��������ͼװ����֤����ˮ�����ķ�Ӧ��
��ʪ���������� ���Թ��з�Ӧ�Ļ�ѧ����ʽ�� ��
��ʵ�������ȡ��������Ӧ��Ĺ������Թ��У�����������ᣬ������ȫ�ܽ⣬������Һ�д��ڵ��������� ������ţ���
a��һ����Fe2+��H+��Fe3+ b��һ����Fe2+��H+��������Fe3+
c��һ����Fe2+��Fe3+�������� H+ d��һ����Fe3+��H+��������Fe2+
��3������ȡһ��������������������Ũ�����У����ȣ���ַ�Ӧ���ռ����塣���ⶨ�����к���SO2��CO2��H2��
�� ����������Ũ���ᷴӦ�Ļ�ѧ����ʽ�� ��
�� ��672 mL����״�����ռ���������ͨ��������ˮ�У�������Ӧ��
SO2 + Br2 + 2H2O = 2HBr + H2SO4��Ȼ���������BaCl2��Һ����ϴ�ӡ�����õ�����4.66 g���ɴ���֪�ռ�����������SO2����������� ���� ���������λ��Ч���֣�
���������λ��Ч���֣�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ϊ�˼���ij�����������Ƿ���NH4+������Ϊ������ֽ�ͺ��Լ�һ���ò�������( )
������ˮ ��NaOH��Һ �ۺ�ɫʯ����ֽ ����ɫʯ����ֽ ��ϡ���ᣮ
A���٢�
B���ܢ�
C���٢�
D���٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з�Ӧ���ڼӳɷ�Ӧ���� (����)
A.��ϩʹ����KMnO4��Һ��ɫ B.��CCl4������ˮ��,��ˮ��ӽ���ɫ
C.��ϩʹ��ˮ��ɫ D.�������������,����һ��ʱ������ɫ��ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
NAΪ�����ӵ���������ֵ������˵������ȷ����
A��5.6g������0.1mol Cl2��ַ�Ӧת�Ƶ���0.3N A
A
B��һ�������£�2.3g��Na��ȫ��O2��Ӧ����3.6g����ʱʧȥ�ĵ�����Ϊ0.1NA
C��1.0L��0.1 mol·L-1 AlCl3��Һ�к��е�Al3+������Ϊ0.1NA
D����״���£�22.4L��CCl4�к��е�CCl4������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������У���NH4+������ͬ�������͵��������� ( )
�� A��OH���������� B��F���������������������� ��C��Na+������D��NH3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪������NaCl�İ�����Һ�г���ͨ��CO2���壻����Na2CO3��Һ��ͨ��������CO2���塣����������Һ�о�������NaHCO3���壬�����й�˵���д�����ǣ� ��
A�����е����ӷ�Ӧ����ʽ�ǣ�Na++NH3+CO2+H2O =NaHCO3�� + NH4+
B�����е����ӷ�Ӧ����ʽ�ǣ�2Na++CO32��+H2O+CO2 = 2NaHCO3��
C�������仯˵����ͬ�¶����ܽ��Na2CO3 > NaHCO3 > NaCl
D����CaCl2��Һ�м���ŨBa(OH)2��Һ��Ҳ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���˺��ʳ��ˮ�Ժ��п����Ե�CaCl2��MgCl2��Na2SO4�����ʣ�ͨ�����¼���ʵ�鲽�裬���Ƶô�����ʳ��ˮ���ټ����Թ�����Na2CO3��Һ���ڼ����Թ�����NaOH��Һ���ۼ����Թ�����BaCl2 ��Һ���ܵ���ϡ�����������ݲ������ݹ��� ��ȷ�IJ���˳�� ��
A���٢ڢۢݢ� B���ۢڢ٢ݢ� C���ڢۢ٢ܢ� D���ۢݢڢ٢�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com