
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
分析 X元素原子原子的L层上s电子数等于p电子数,核外电子排布为1s22s22p2,则X为C元素;Y元素原子核外的L层有3个未成对电子,核外电子排布为1s22s22p3,则Y为N元素;在元素周期表的各元素中Z的电负性仅小于氟,则Z为O元素;Q元素单质常温、常压下是气体,原子的M层上有1个未成对的p电子,原子核外电子排布为1s22s22p63s23p5,则Q为Cl;R的核电荷数是Y与Q的核电荷数之和,其核电荷数=7+17=24,则R为Cr;E原子序数比R大3,则E为Co,据此解答.
解答 解:X元素原子原子的L层上s电子数等于p电子数,核外电子排布为1s22s22p2,则X为C元素;Y元素原子核外的L层有3个未成对电子,核外电子排布为1s22s22p3,则Y为N元素;在元素周期表的各元素中Z的电负性仅小于氟,则Z为O元素;Q元素单质常温、常压下是气体,原子的M层上有1个未成对的p电子,原子核外电子排布为1s22s22p63s23p5,则Q为Cl;R的核电荷数是Y与Q的核电荷数之和,其核电荷数=7+17=24,则R为Cr;E原子序数比R大3,则E为Co.
(1)Y元素原子核外的L层有3个未成对电子,核外电子排布为1s22s22p3,原子核外共有7种不同运动状态的电子,有 3种不同能级的电子.
故答案为:7;3;
(2)C、N、O同周期,随原子序数增大,元素的电负性增大,故电负性O>N>C,
故答案为:O>N>C;
(3)X、Z元素均表现最低化合价时的氢化物分别为CH4、H2O中,水分子之间存在氢键,甲烷分子之间不能形成氢键,故沸点:H2O>CH4,
故答案为:H2O>CH4;
(4)R为Cr,处于VIB族,最高价为+6价,根据题意知,氯化铬(CrCl3•6H2O)和氯化银的物质的量之比是1:2,根据氯离子守恒知,则CrCl3•6H2O化学式中含有2个氯离子为外界离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3•6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2•H2O,
故答案为:+6;B;
(5)元素Co能形成八面体构型的配合物离子[E (YH3)xQ2]+,该配合物离子为:[Co (NH3)4Cl2]+,
故答案为:[Co (NH3)4Cl2]+;
(6)Y的最低价氢化物为NH3,与Z的一种氢化物反应,生成的两种产物均不污染环境,则Z的氢化物为H2O2,反应生成氮气与水,其反应的化学方程式为:2NH3+3H2O2=N2+6H2O,
故答案为:2NH3+3H2O2=N2+6H2O.
点评 本题考查结构性质位置关系应用,涉及核外电子排布、电负性、氢键、配合物、元素化合物性质等,难度中等,明确元素种类是关键,(4)中注意配合物中外界离子与配体性质区别.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠离子与氯离子F之间存在互相吸引又互相排斥的相互作用 | |
| B. | 不存在氯化钠的分子 | |
| C. | 每个钠离子同时吸引6个氯离子,每个氯离子同时吸引6个钠离子 | |
| D. | 在一个钠离子周围距离相等,并且最接近的钠离子共有6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
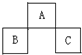 A、B、C均为周期表中的短周期的元素,它们在周期表的位置如下图.已知B、C两元素在周期表中族数之和是A元素族数的2倍;B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C所在的一组是 ( )
A、B、C均为周期表中的短周期的元素,它们在周期表的位置如下图.已知B、C两元素在周期表中族数之和是A元素族数的2倍;B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C所在的一组是 ( )| A. | Be、Na、Al | B. | P、O、Cl | C. | O、P、Cl | D. | C、Al、P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
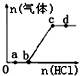 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、Ca2+、SO42-、NO3- | |
| B. | b点对应的溶液中:K+、Na+、OH-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
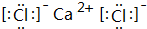 .
. ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8电子的稳定结构,该分子的结构式为S=C=S.
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8电子的稳定结构,该分子的结构式为S=C=S.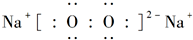 (填电子式),其化学键类型为离子键、非极性共价键(填“离子键”、“非极性共价键”、“极性共价键”中的一种或多种).
(填电子式),其化学键类型为离子键、非极性共价键(填“离子键”、“非极性共价键”、“极性共价键”中的一种或多种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ⑤⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C4H8 | B. | CH4和C3H6 | C. | C2H6 和C3H6 | D. | C2H6 和C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
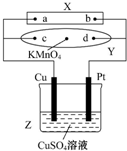 图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散.下列判断正确的是( )
图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散.下列判断正确的是( )| A. | 滤纸上c点附近会变红色 | B. | Cu电极质量减小,Pt电极质量增大 | ||
| C. | Z中溶液的pH先减小,后增大 | D. | 溶液中的SO42-向Cu电极定向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com