
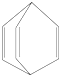
| A. | 桶烯分子中所有原子在同一平面内 | |
| B. | 桶烯在一定条件下能发生加成反应和聚合反应 | |
| C. | 桶烯与苯乙烯(C6H5CH═CH2)互为同分异构体 | |
| D. | 桶烯中的一个氢原子被氯原子取代,所得产物只有一种 |
分析 该分子中含有碳碳双键,具有烯烃性质,能发生加成反应、加聚反应,具有甲烷结构的碳原子连接的原子不能在同一平面上,分子式相同结构不同的有机物互称同分异构体,据此分析解答.
解答 解:A.两端的碳原子具有甲烷中碳原子结构,所以该分子中所有原子不可能处于同一平面上,故A错误;
B.含有碳碳双键,所以一定条件下能发生加成反应、聚合反应,故B正确;
C.桶烯和苯乙烯的分子式都是C8H8且二者结构不同,所以互为同分异构体,故C正确;
D.桶烯中只含2类氢原子,所以桶烯中的一个氢原子被氯原子取代,所得产物只有2种,故D错误;
故选AD.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系即可解答,侧重考查烯烃性质,难点是原子共面判断,以甲烷为例采用知识迁移方法判断,易错选项是A.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | 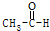 +H2$\stackrel{催化剂}{→}$CH3CH2OH +H2$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. | H2+Cl2═2HCl | D. | 2CH3CH2OH+O2→2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
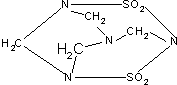
| A. | 毒鼠强属于无机物 | B. | 毒鼠强属于烃 | ||
| C. | 毒鼠强为高分子化合物 | D. | 毒鼠强为有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将甲烷和乙烯的混合气体通过酸性高锰酸钾溶液,可除去乙烯 | |
| B. | 配制银氨溶液:在一定量AgNO3溶液中,逐滴滴加稀氨水至沉淀恰好溶解为止 | |
| C. | 验证RX为碘代烷,把RX与烧碱水溶液混合加热,将溶液冷却后再加入硝酸银溶液 | |
| D. | 无水乙醇和浓硫酸共热至170℃,将制得的气体通入酸性高锰酸钾可检验制得的气体是否为乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
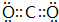 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ③⑥ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com