


科目:高中化学 来源: 题型:阅读理解
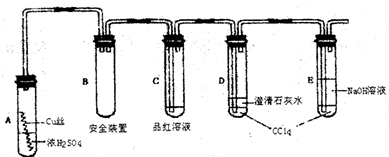
| ||
| ||
| ||
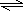 Cu(OH)2+2H+
Cu(OH)2+2H+ Cu(OH)2+2H+
Cu(OH)2+2H+查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl- | 取少许滤液于试管中, 加入硝酸酸化的硝酸银溶液 加入硝酸酸化的硝酸银溶液 |
有白色沉淀产生 有白色沉淀产生 |
含有Cl- |
| 2.检验NH4+ | 取少许滤液于试管中, 加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 |
石蕊试纸变蓝色 石蕊试纸变蓝色 |
含有NH4+ |
| 3.检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl- | 取少量滤液于试管中, |
含有Cl- | |
| 2.检验NH4+ | 取少量滤液于试管中, |
含有NH4+ | |
| 3.检验Zn2+ | 取少量滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加氨水,沉淀溶解 | 含有Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
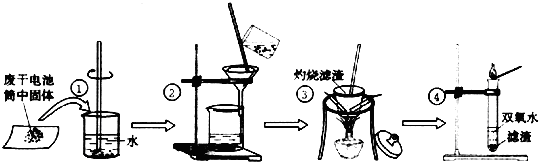
(10分,每空1分)某同学在探究废干电池内的黑色固体回收利用时,进行如图示实验:
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、三角架 、 ;
(2)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气
体,据此可初步认定黑色固体为 。
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测
滤渣中还存在的物质为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1、检验Cl— | 取少许滤液于试管中,
|
| 含有Cl— |
| 2、检验NH4+ | 取少许滤液于试管中,
|
| 含有NH4+ |
| 3、检验Zn2+ | 取少许滤液于试管中,加入 稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
(5)根据以上的实验报告,关于滤液的成分,你的结论是: 。通过一定的操作从滤液中得到固体溶质, 若要将所得固体溶质中的物质加以分离,可用 法。
查看答案和解析>>
科目:高中化学 来源:2011届山东省济宁一中高三第一次模拟测试试题理综化学试卷 题型:实验题
(12分)乱扔废旧电池会导致严重的环境污染,一节废电池就是一颗“炸弹”。某化学兴趣小组的同学在探究废干电池内的黑色固体回收利用时,进行了如图所示的实验:

查阅教材可得到下列信息:
①普通锌锰电池的黑色物质主要成分为MnO2.NH4Cl.ZnCl2等物质。
②Zn(OH)2能溶解于过量的氨水中。
请回答以下问题:
(1)操作③灼烧滤渣时所用到的主要仪器有酒精灯.玻璃棒. .泥三角和三脚架;灼烧滤渣中的黑色固体时,产生一种使澄清的石灰水变浑浊的气体,由此推测滤渣中还存在碳。
(2)操作④的试管中加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为 。
(3)该同学对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
| 实验目的 | 操作 | 实验现象 | 结论 |
| 检验Cl- | 取少许滤液于试管中, | | 含有Cl- |
| 检验NH4+ | 取少许滤液于试管中, | | 含有NH4+ |
| 检验Zn2+ | 取少许滤液于试管中, | | 含有Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com