
【题目】江水受到污染,其污染的主要原因是 ( )
①工业生产中废液的任意排放 ②雨水和土壤的长期接触 ③农业生产中农药、化肥的过量施用 ④城市生活污水的任意排放
A.①②③
B.②③④
C.①③④
D.①②③④
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A和B 为原料合成扁桃酸衍生物F路线如下: 
(1)根据流程图分析出G的命名 , 写出C和G反应生成D的反应方程式
(2)已知B为苯酚,A和B反应生成C的反应是加成反应.A可发生银镜反应,且具有酸性,则A的分子式为:
(3)E是由2分子C生成的含有3个六元环的化合物,写出E的结构简式 .
(4)D→F的反应类型是 , 写出D→F的化学反应方程式
(5)符合下列条件的F的所有同分异构体(不考虑立体异构)的结构有种
①、属于一元酸类化合物,②、苯环上只有2个取代基且处于对位,其中一个是羟基
(6)A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:
H2C=CH2 ![]() CH3CH2OH
CH3CH2OH ![]() CH3COOC2H5 , 合成路线的第一步已经写出,请在下面框中完成后续的合成路线流程图:CH3CCOOH
CH3COOC2H5 , 合成路线的第一步已经写出,请在下面框中完成后续的合成路线流程图:CH3CCOOH ![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原子结构的叙述正确的是( )
A. 所有的原子核都是由质子和中子组成的
B. 原子的最外层电子数不超过8个
C. 稀有气体原子的最外层电子数均为8
D. 原子的次外层电子数都是2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组利用图1装置探究SO2的性质.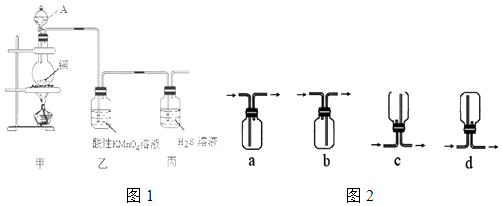
请回答下列问题:
(1)装置甲中A仪器的名称是 .
(2)装置乙中出现的现象是 , 可以证明SO2具有(填代号).装置丙中发生反应的化学方程式为 , 可以证明SO2具有(填代号).
a.氧化性 b.还原性 c.漂自性
(3)收集SO2气体可以选择的装置如图2为(填代号).从环保的角度考虑,收集装置的出气口需要连接一个盛有(填化学式)溶液的洗气瓶.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用等体积的0.15mol L﹣1的BaCl2溶液,可使相同体积的Na2SO4、Fe2(SO4)3、KAl(SO4)2三种溶液中的SO42﹣完全沉淀,则三种硫酸盐的物质的量浓度之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F、G均是常见的香料,可通过下列途径合成,合成路线如图: 
回答下列问题
(1)B的名称为 .
(2)③的反应类型是;④的反应类型是 .
(3)C的结构简式是;A加聚产物的结构简式是 .
(4)F分子中位于同一平面的碳原子最多有个.
(5)G的芳香同分异构体中且能发生银镜反应和水解反应的异构体有种,其中核磁共振氢谱只有四组峰的异构体结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)26H2O的流程如图1: 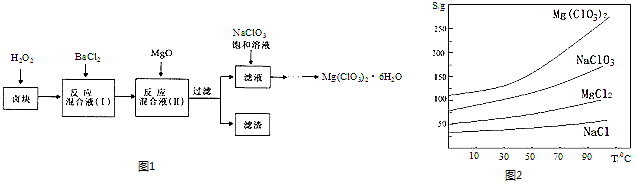
已知:①卤块主要成分为MgCl26H2O,含有MgSO4、FeCl2等杂质.
②四种化合物的溶解度(S)随温度(T)
变化曲线如图2所示.回答下列问题:
(1)过滤时主要的玻璃仪器有 .
(2)加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是 .
(3)加速卤块在H2O2溶液中溶解的措施有:(写出一条即可)
(4)加入MgO的作用是; 滤渣的主要成分为 .
(5)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为:MgCl2+2NaClO3=Mg(ClO3)2↓+2NaCl,再进一步制取Mg(ClO3)26H2O的实验步骤依次为①;②趁热过滤;③;④过滤、洗涤、干燥.
(6)产品中Mg(ClO3)26H2O含量的测定: 步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL 1.000molL﹣1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.l000molL﹣1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00mL.
①请写出步骤2中发生反应的离子方程式(还原产物为Cl﹣)
②产品中Mg(ClO3)26H2O的质量分数为 . (计算结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com