
【题目】为测定某有机化合物A的结构,进行如下实验:
I. 分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质的实验式是__________.

(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为_______,该物质的分子式是_______.
(3)根据有机化合物的成键特点,预测A的可能结构并写出结构简式__________.
II.结构式的确定:
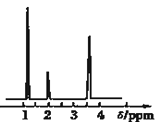
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.经测定,有机物A的核磁共振氢谱示意图如图②,则A的结构简式为_________.
【答案】C2H6O 46 C2H6O CH3CH2OH或CH3OCH3 CH3CH2OH
【解析】
(1)计算水、二氧化碳、氧气物质的量,根据原子守恒计算分子中C、H、O原子数目之比确定实验式。
(2)根据质荷比可知相对分子质量为46,结合最简式确定分子式。
(3)根据分子式书写可能的结构简式。
(4)有机物A的核磁共振氢谱中有3个吸收峰,说明有3种性质不同的H原子,结合分子式确定结构简式。
(1) 5.4gH2O的物质的量=![]() =0.3mol,则n(H)=0.6mol,8.8gCO2的物质的量
=0.3mol,则n(H)=0.6mol,8.8gCO2的物质的量![]() =0.2mol,则n(C)=0.2mol,6.72LO2的物质的量
=0.2mol,则n(C)=0.2mol,6.72LO2的物质的量![]() =0.3mol,由O元素守恒可知有机物中含有
=0.3mol,由O元素守恒可知有机物中含有![]() ,则分子中
,则分子中![]() ,故实验式为:C2H6O;
,故实验式为:C2H6O;
故答案为: C2H6O;
(2)由质谱图可知其相对分子质量为46,结合试验可知分子式为C2H6O;
故答案为:46;C2H6O;
(3)分子式为C2H6O的可能结构简式为:CH3CH2OH或CH3OCH3;
故答案为:CH3CH2OH或CH3OCH3;
(4)有机物A的核磁共振氢谱中有3个吸收峰,说明有3种性质不同的H原子,故A的结构为:CH3CH2OH;
故答案为:CH3CH2OH。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A. Cl2+H2O![]() HCl+HClO,氯水中加入碳酸钙,漂白性增强
HCl+HClO,氯水中加入碳酸钙,漂白性增强
B. ZnS + Cu2+![]() CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C. 2NO2![]() N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
D. Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃和某单烯烃的混合气体2.24 L(标准状况),使其完全燃烧,产生的气体完全通过浓硫酸,浓硫酸质量增加4.50 g,剩余气体通过碱石灰,碱石灰质量增加了7.70 g,另取该混合气体2.24 L(标准状况),通过足量溴水,溴水质量增加了1.40 g。该混合气体由哪两种烃组成( )
A.甲烷和丙烯B.甲烷和丁烯C.乙烷和乙烯D.乙烷和丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,在浓度为
时,在浓度为![]() 的
的![]() 、
、![]() 、
、![]() 的溶液中,已知醋酸的电离常数约等于一水合氨的电离常数,下列判断正确的是
的溶液中,已知醋酸的电离常数约等于一水合氨的电离常数,下列判断正确的是![]()
A.由水电离出的![]() 最大的是
最大的是![]()
B.三种溶液的pH值最小的![]()
C.三种溶液中![]() 最大的是
最大的是![]()
D.三种溶液中只有![]() 显碱性
显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgI为黄色沉淀,AgCl为白色沉淀,![]() 时,AgI饱和溶液中
时,AgI饱和溶液中![]() 为
为![]() ,AgCl饱和溶液中
,AgCl饱和溶液中![]() 为
为![]() 。若在5mL含有KCl和KI浓度均为
。若在5mL含有KCl和KI浓度均为![]() 的混合溶液中,滴加8mL
的混合溶液中,滴加8mL![]() 的
的![]() 溶液,则下列叙述中不正确的是
溶液,则下列叙述中不正确的是
A.溶液中所含溶质的离子浓度大小关系为:![]()
B.溶液中先产生的是AgI沉淀
C.AgCl的![]() 的数值为
的数值为![]()
D.在AgI悬浊液中滴加KCl溶液,可能使黄色沉淀转变成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用。请回答下列问题:

Ⅰ:(1)工业生产尿素的原理是以![]() 和
和![]() 为原料合成尿素
为原料合成尿素![]() ,反应的化学方程式为:
,反应的化学方程式为:![]() 。
。
①已知该反应的平衡常数![]() ,则该反应的
,则该反应的![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
②一定温度和压强下,若原料气中的![]() 和
和![]() 的物质的量之比
的物质的量之比![]() 氨碳比
氨碳比 ,图1是氨碳比
,图1是氨碳比![]() 与
与![]() 平衡转化率
平衡转化率![]() 的关系,
的关系,![]() 随着x增大的原因是______;B点处,
随着x增大的原因是______;B点处,![]() 的体积分数为______
的体积分数为______![]() 保留小数点后一位
保留小数点后一位![]() 。
。
③取一定量的![]() 和
和![]() 放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,
放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,![]() 的质量______
的质量______![]() 填“增加”、“减小”或“不变”
填“增加”、“减小”或“不变”![]() 。
。
Ⅱ:(1)某温度下,纯水中![]() ,该温度下,
,该温度下,![]() NaOH溶液与
NaOH溶液与![]() HCl溶液等体积混合
HCl溶液等体积混合![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() 后,溶液的
后,溶液的![]() ______。
______。
(2)向100mL![]()
![]() 的溶液中加入
的溶液中加入![]()
![]() 固体,溶液pH增大,主要原因是
固体,溶液pH增大,主要原因是![]() 请用学过的平衡理论解释
请用学过的平衡理论解释![]() ______;已知该混合溶液中
______;已知该混合溶液中![]() ,则
,则![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
Ⅲ:(1)图2为某温度下,![]() 、
、![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,溶液的
分别在溶液中达到沉淀溶解平衡后,溶液的![]() 浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______
浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______![]() 填化学式
填化学式![]() 。
。
(2)向新生成的ZnS浊液中滴入足量含相同浓度的![]() 、
、![]() 的溶液,振荡后,ZnS沉淀最终会转化为______
的溶液,振荡后,ZnS沉淀最终会转化为______![]() 填化学式
填化学式![]() 沉淀。
沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 检验蔗糖水解生成葡萄糖 | 取适量蔗糖溶于盛有蒸馏水的试管中,滴入稀硫酸加热一段时间,冷却,滴入新制氢氧化铜悬浊液,加热至沸腾,观察有无砖红色沉淀 |
B | 实验室制备氢氧化铁胶体 | 向盛有25mL蒸馏水的烧杯中滴入5-6滴氯化铁饱和溶液,加热煮沸至溶液呈红褐色,停止加热 |
C | 比较AgCl、AgI的Ksp大小 | 向盛有10滴0.1mol/LAgNO3 溶液的试管中滴加0.1mol/LNaCl溶液至不再有沉淀生成,再滴加0.1mol/lKI溶液 |
D | 比较Mg、Al的金属性强弱 | 用导线连接镁和铝片,插入盛有氢氧化钠溶液的烧杯中,观察气泡 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx会造成大气污染,在工业上采用多种方法进行处理。
I.氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,CaSO4的沉淀溶解平衡常数数值为9.1×10-6,CaSO3的沉淀溶解平衡常数数值为3.1×10-7。
(1)NO与O3反应过程的能量变化如下:

NO被O3氧化的总反应是化合反应,该反应的热化学方程式为 ________。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为________。
(3)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为________。
(4)在实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:________。
II. 选择性非催化还原法:该反应不使用催化剂,但必须在高温有氧下利用NH3做还原剂与 NOx 进行选择性反应:4NH3 + 4NO + O2 ![]() 3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。

(5)判断该反应为________(填“吸热”或“放热”)反应,说明理由:________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com