
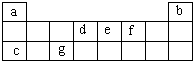
| A、e和f组成的化合物可吸收宇航员在宇宙飞船活动舱内产生的由d和f组成的气体 |
| B、活动舱内还要营造一种适合宇航员生存的人工生态环境,即充入a和f的常见单质 |
| C、c和f以原子个数之比为1:1组成的化合物可用作宇航员所需f单质的来源 |
| D、若潘多拉星球上存在b,地球上此元素主要以b形式存在,b比b少一个质子 |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| A、在熔化状态下能导电的化合物为离子化合物 |
| B、根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 |
| C、CO2、SiO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物 |
| D、因为Na2O的水溶液能导电,所以Na2O是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ | ||||
| 阴离子 | OH- Cl- C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属钠和过氧化钠分别与水反应有很多值得探究的问题.
金属钠和过氧化钠分别与水反应有很多值得探究的问题.| 实验操作 | 预期的实验现象和结论 |
| 实验操作 | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是有关钠与水反应及产物验证的改进实验装置.实验开始时先向管内加入滴有酚酞的水,使水位至B端管口,如图所示,迅速塞紧橡胶塞(此时活塞a是关闭的),使钠块掉入水中.回答下列问题:
如图是有关钠与水反应及产物验证的改进实验装置.实验开始时先向管内加入滴有酚酞的水,使水位至B端管口,如图所示,迅速塞紧橡胶塞(此时活塞a是关闭的),使钠块掉入水中.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.
氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.| n(NH3) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制FeCl3溶液时,常将FeCl3先溶于盐酸,然后再加水稀释 |
| B、用加热蒸发Na2CO3溶液的方法获得Na2CO3晶体 |
| C、向沸水中滴加FeCl3溶液来制取Fe(OH)3胶体 |
| D、直接加热MgCl2溶液制取无水MgCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com