
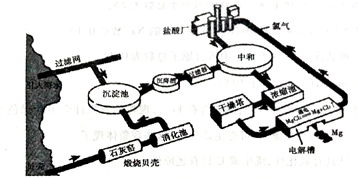
分析 (1)贝壳高温煅烧生成氧化钙和二氧化碳;
(2)①海水中加入贝壳煅烧得到氧化钙溶于水生成的氢氧化钙沉淀镁离子生成氢氧化镁沉淀,过滤得到氢氧化镁沉淀中加入盐酸溶解得到氯化镁溶液,蒸发浓缩,冷却结晶,过滤洗涤得到氯化镁晶体,氯化氢气流中加热失去结晶水得到固体氯化镁固体,电解熔融氯化镁得到金属镁;
②MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,依据化学方程式电子转移总数计算;
(3)提高经济效益的措施是循环利用生成的氯气,利用海滩上的贝壳做原料等;
(4)a.如果管道漏气,则发生反应3Cl2+2NH3=N2+6HCl,生成HCl气体继续与氨气反应生成氯化铵,现象为有白烟生成,反应中氯气表现出氧化性,
b.根据氨气具有刺激性气味;
c.根据N元素的化合价由-3价升高到0价可知,元素化合价升高失电子做还原剂被氧化得到氧化产物氮气,氯元素化合价降低做氧化剂被还原生成氯化氢.
解答 解:(1)贝壳高温煅烧生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3$\frac{\underline{\;煅烧\;}}{\;}$CaO+CO2↑,
故答案为:CaCO3$\frac{\underline{\;煅烧\;}}{\;}$CaO+CO2↑;
(2)①海水中加入贝壳煅烧得到氧化钙溶于水生成的氢氧化钙沉淀镁离子生成氢氧化镁沉淀,反应的化学方程式为:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,过滤得到氢氧化镁沉淀中加入盐酸溶解得到氯化镁溶液,Mg(OH)2+2HCl=MgCl2+2H2O,蒸发浓缩,冷却结晶,过滤洗涤得到氯化镁晶体,氯化氢气流中加热失去结晶水得到固体氯化镁固体,电解熔融氯化镁得到金属镁,反应的化学方程式为:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,Mg(OH)2+2HCl=MgCl2+2H2O;
②MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,依据化学方程式计算电子转移总数,每生成1molMg电子转移2NA,
故答案为:2NA;
(3)提高经济效益的措施是循环利用生成的氯气,利用海滩上的贝壳做原料等,
故答案为:氯气循环利用;
(4)a、如果管道漏气,发生反应3Cl2+2NH3=N2+6HCl,反应生成HCl,HCl与NH3反应生成NH4Cl,现象为有白烟生成,故a正确;
b.氨气具有刺激性气味,所以管道泄漏处会闻到刺激性气味,故b正确;
c.2NH3+3Cl2=N2+6HCl反应中N元素的化合价由-3价升高到0价可知,元素化合价升高失电子做还原剂被氧化得到氧化产物氮气,氯元素化合价降低做氧化剂被还原生成还原产物氯化氢,故c错误;
故答案为:ab.
点评 本题考查了海水提取金属镁的工业流程及其反应原理分析,注意物质性质的理解应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加KSCN 溶液,溶液呈血红色,证明存在Fe3+ | |
| B. | 氢氧化钠溶液保存在带橡皮塞的试剂瓶中 | |
| C. | 漂白粉常作环境消毒剂 | |
| D. | 工业上用电解饱和食盐水来制取金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl+AgNO3═AgCl+HNO3 | B. | MnO2+4HCl(浓)═MnCl2+Cl2↑+H2O | ||
| C. | 2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | D. | Mg+2HCl═MgCl2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入紫色石蕊试液中,试液不会褪色 | |
| B. | SO2与Cl2等物质的量混合,可增强漂白效果 | |
| C. | 既有氧化性,又有还原性 | |
| D. | 既可溶于水,又可与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+.Cl-.HCO3-.K+ | B. | Na+.Al3+.Cl-.SO42- | ||
| C. | NH4+.SO32-.Na+ NO3- | D. | Na+.SO42-.[Al(OH)4]-.OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
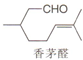
| A. | 分子式是C10H18O | B. | 至少有六个碳原子处于同一平面 | ||
| C. | 能与新制Cu(OH)2悬浊液反应 | D. | 能与H2或Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | CaCO3与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| D. | Cu与FeCl3溶液反应:Cu+Fe3+═Cu2++Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com