
| A. | 100 mL 0.5 mol•L-1MgCl2溶液 | B. | 200 mL 0.25 mol•L-1AlCl3溶液 | ||
| C. | 50 mL 1 mol•L-1NaCl溶液 | D. | 25 mL 0.5 mol•L-1HCl溶液 |
分析 氯离子的物质的量浓度与溶质浓度、溶质的化学式组成有关,与溶液体积大小无关,如:100mL 0.5mol•L-1 NaCl溶液中所含Cl-的物质的量浓度为0.5mol/L,据此进行解答.
解答 解:100mL 0.5mol•L-1 NaCl溶液中所含Cl-的物质的量浓度为0.5mol/L,
A.100 mL 0.5 mol•L-1MgCl2溶液中所含Cl-的物质的量浓度为:0.5mol/L×2=1mol/L;
B.200 mL 0.25 mol•L-1AlCl3溶液中所含Cl-的物质的量浓度为:0.25mol/L×3=0.75mol/L;
C.50 mL 1 mol•L-1NaCl溶液中所含Cl-的物质的量浓度为:1mol/L×1=1mol/L;
D.25mLmL 0.5 mol•L-1HCl溶液中所含Cl-的物质的量浓度为:0.5mol/L×1=0.5mol/L;
根据分析可知,氯离子浓度为0.5mol/L的为D,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确氯离子的浓度与溶液体积大小无关为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:多选题
| A. | 向稀盐酸中加入少量钠粒:2Na+2H2O→2Na++2OH-?+H2↑ | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| C. | 用漂白粉溶液吸收尾气中SO2:Ca2++2ClO-+SO2+H2O→CaSO3↓+2HClO | |
| D. | 向含氯化铝的氯化镁溶液中加入氧化镁:2Al3++3MgO+3H2O=2Al(OH)3↓+3Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的有机物都能与醋酸发生酯化反应 | |
| B. | 氨基酸、乙酸和苯酚都能与氢氧化钠溶液反应 | |
| C. | 醇类、卤代烃都能发生消去反应 | |
| D. | 除饱和烃之外的其他烃都能发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
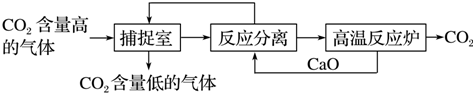
| A. | 生产过程中,可循环利用的物质有CaO和NaOH | |
| B. | 该方法涉及了化合、分解和复分解等反应类型 | |
| C. | 该方法通过化学变化,分离、提纯并利用CO2,可以减少碳的排放 | |
| D. | “反应分离”环节中,分离物质的基本操作是蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与漂白粉溶液反应的离子方程式:Ca2++SO32-═CaSO3↓ | |
| B. | 通入SO2至过量:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| C. | 通入HCl至溶液pH=7:c(HSO3-)<c(Cl-) | |
| D. | 加入NaOH固体可使溶液中水的电离程度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH 加成反应 | |
| B. | 2CH3CH2OH $?_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O 消去反应 | |
| C. |  $?_{△}^{浓硫酸}$ $?_{△}^{浓硫酸}$ 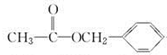 +H2O取代反应 +H2O取代反应 | |
| D. |  加聚反应 加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 用FeCl3溶液腐蚀铜来制作印刷电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| D. | 向Al (SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用S制备H2SO4 | B. | 用CaCO3、Na2CO3、SiO2生产玻璃 | ||
| C. | 将海水中的MgSO4转变为金属Mg | D. | 用NO2生产HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cu与含2 mol H2SO4的浓硫酸加热反应,转移的电子数为 2 NA | |
| B. | 5.80g[2 CaSO4.H2O]中含有的H2O分子数为0.04NA(M(2 CaSO4.H2O)=290g.nol-1) | |
| C. | 0.1 mol BaO2与足量的CO2完全反应转移电子数目为0.1NA | |
| D. | 10 mL 5 mol•L-1(NH4)2CO3溶液中含有N原子数目小于0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com