
【题目】周期表中前四周期的元素A、B、C、D,原子序数依次增大,且A、B、C同周期。A共有两个原子轨道上有电子,且电子数目相同。B、C相邻,且C中的未成对电子数为3个,D是人类最早使用的元素,并以这种元素命名了一个时代。请回答下面的问题:
(1)A、B、C第一电离能从小到大的顺序为:__________________(填元素符号),D的价层电子排布图为:_______________________。
(2)在不同的温度下,A以ACl2和二聚体 A2Cl4两种形式存在,二聚体的结构式如下图所示:
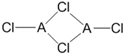
①ACl2中A的杂化方式为_____________。
②1mol A2Cl4中含配位键的数目为_____________。
(3)B元素能形成多种同素异形体,其中一种同素异形体X的晶体结构和晶胞结构如图所示。已知X的密度是a g/cm3,B-B键的键长为r cm,阿伏加德罗常数的值为NA。
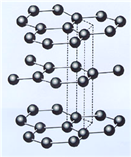
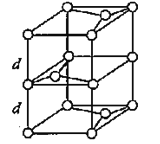
X的晶体结构(左)和晶胞(右)
①X中含有的化学键为____________________。
②X晶体的层间距离为___________________。
(4)C元素可以形成两种含氧酸HCO2和HCO3,酸性是HCO3___HCO2(填“强于”或者“弱于”),原因为__________________________。
(5)将二维密置层在三维空间内堆积,可以得到两种金属晶体的最密堆积方式。一种是按照XYXYXYXY……方式堆积,我们称这种堆积方式为“甲”方式。另外一种是按照XYZXYZXYZXYZ……方式堆积,我们称这种堆积方式为“乙”方式。则金属D的堆积方式为_______。(填“甲”或“乙”)
【答案】 Be<C<N ![]() sp
sp ![]() 共价键 金属键
共价键 金属键 ![]() cm 强于 HNO3中含有更多的非羟基氧,C的正电性越高,导致N-O-H中的电子向N偏移,因而在水分子的作用下就越容易电离出H+,即酸性越强。 乙
cm 强于 HNO3中含有更多的非羟基氧,C的正电性越高,导致N-O-H中的电子向N偏移,因而在水分子的作用下就越容易电离出H+,即酸性越强。 乙
【解析】周期表中前四周期的元素A、B、C、D,原子序数依次增大。A共有两个原子轨道上有电子,且电子数目相同,则A的电子排布式为1s22s2,所以A为4号铍元素。且A、B、C同周期,B、C相邻,且C中的未成对电子数为3个所以C为7号N元素,则B是6号C元素。人类最早使用的金属是铜,D是人类最早使用的元素,所以D是29号元素Cu。
(1)A、B、C第一电离能从小到大的顺序为:Be<C<N,D的价层电子排布图为:![]() 。
。
(2)①BeCl2中心原子Be形成2个σ键且没有孤电子对,价层电子对数为2对,所以Be的杂化方式为sp杂化。
②1个氯化铍二聚体分子中有2个配位键,所以1mol Be2Cl4中含配位键的数目为![]() 。
。
(3)①由X的晶体及晶胞结构特点可知,X为石墨。石墨是混合晶体,碳原子采用sp2杂化与周围3个碳原子形成共价键,每个碳原子还有一个电子在2p轨道上,同一片层所有碳原子的未参与形成σ键的2p轨道相互平行并形成了大π键,这些2p轨道中的电子可以在整个层内自由运动,所以石墨具有导电性,因此石墨中含有的化学键为共价键、金属键。
②每个晶胞中占有的C原子数=![]() ,则NA个该晶胞的质量为48g.该晶胞是四棱柱,底面是连长为
,则NA个该晶胞的质量为48g.该晶胞是四棱柱,底面是连长为![]() r cm 的菱形,高为2d,所以该晶胞的体积为V:V=
r cm 的菱形,高为2d,所以该晶胞的体积为V:V=![]() ,
,
NA个该晶胞的体积为![]() ,由上面两个数据可以表示出晶胞的密度为
,由上面两个数据可以表示出晶胞的密度为
![]() =
=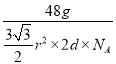 =a g/cm3,解之得d=
=a g/cm3,解之得d=![]() (单位是cm),即X晶体的层间距离为
(单位是cm),即X晶体的层间距离为![]() cm。
cm。
(4)N元素可以形成两种含氧酸HNO2和HNO3,酸性是HNO3强于HNO2,
原因为HNO3中含有更多的非羟基氧,N的正电性越高,导致N-O-H中的电子向N偏移,因而在水分子的作用下就越容易电离出H+,即酸性越强。
(5)将二维密置层在三维空间内堆积,可以得到两种金属晶体的最密堆积方式。一种是按照XYXYXYXY……方式堆积,我们称这种堆积方式为“甲”方式。甲方式的晶胞是六方最密堆积。另外一种是按照XYZXYZXYZXYZ……方式堆积,我们称这种堆积方式为“乙”方式。乙方式的晶胞是面心最密堆积。因为金属铜的晶胞是面心立方,所以金属Cu的堆积方式为乙。


科目:高中化学 来源: 题型:
【题目】已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。下列叙述错误的是( )

A.在pH=1.3的溶液中:c(Na+)<c(H2R)+2c(R2-)
B.等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水小
C.在pH=2的溶液中存在![]() =10-3
=10-3
D.向Na2CO3溶液中加入过量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气充电电池有望成为电动汽车的实用储能设备。工作原理示意图如下,下列叙述正确的是
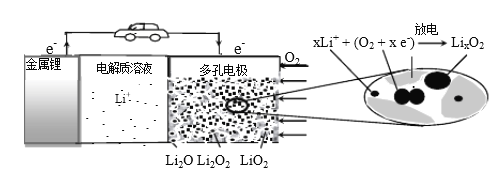
A. 该电池工作时Li+向负极移动
B. Li2SO4溶液可作该电池电解质溶液
C. 电池充电时间越长,电池中Li2O 含量越多
D. 电池工作时,正极可发生: 2Li+ +O2+ 2e-=Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种有机物甲、乙、丙,其结构如图所示:

下列有关说法中错误的是
A.甲、乙、丙都是芳香族化合物,只有两种能与碳酸氢钠溶液反应
B.只用碳酸氢钠溶液和银氨溶液能检验甲、乙、丙
C.与足量氢气反应,相同物质的量的甲、乙、丙消耗氢气的物质的量之比为3∶4∶3
D.甲的化学式为C11H14O2,乙含有两种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国“蛟龙号多次刷新“中国深度”,为我国深海矿物资源的开发奠定了坚实的基础。黄铜矿(主要成分为CuReS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1)“蛟龙”号外壳用特殊的钛合金材料制成,它可以在7000米的深海中承受710吨的重量。下列说法正确的是___。
A.金属钛属于主族元素
B.钛合金强度不是很大
C.制备钛铝合金时可在空气中将两种金属熔化后混合而成
D.已知金属钛能与H2O反应,可用电解熔融二氧化钛冶炼金属钛
(2)利用黄铜矿冶炼铜的反应为8CuReS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是___。(填元素符号),生成1molFe2O3时转移电子的物质的量为___。
8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是___。(填元素符号),生成1molFe2O3时转移电子的物质的量为___。
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为①用过量稀盐酸浸取炉渣,过滤。②先将滤液氰化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煆烧得Fe2O3。据以上信息回答下列问题:
a.①中过滤的目的是___,过滤需要的仪器有___。
b.除去A13+的化学方程式为___。
c.②中将滤液氧化常常选用H2O2,其反应的离子方程式为___。
(4)将Cu放入0.1molL-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烧食品中;NH4HSO4在分析试剂、医药、电子工业中用途认识广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是__(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1mol·L-1NH4Al(SO4)2中c(NH4+)__(填“等于”“大于”或“小于”)0.1mol·L-1NH4HSO4中c(NH4+)。
(3)20℃时,0.1mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=__(表达式)。
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。
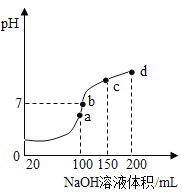
试分析图中a、b、c、d四个点,水的电离程度最大的是___点;在b点,溶液中各离子浓度由大到小的排列顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对苯及芳香烃的认识有一个不断深化的过程。
(1)已知分子式为C6H6的结构有多种,其中的两种为:
Ⅰ![]() Ⅱ
Ⅱ![]()
①这两种结构的区别表现在定性方面(即化学性质方面):Ⅱ能_______,而Ⅰ不能。
a.被酸性高锰酸钾溶液氧化 b.与溴水发生加成反应
c.与溴发生取代反应 d.与氢气发生加成反应
②C6H6还可能有另一种立体结构(如图所示),该结构的二氯代物有____种。
![]()
(2)萘也是一种芳香烃,它的分子式是C10H8,请你判断它的结构简式可能是下列中的____。
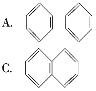
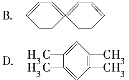
(3)根据第(2)小题中判断得到的萘的结构简式,它不能解释萘的下列事实中的____。
A.萘不能使酸性高锰酸钾溶液褪色 B.萘能与H2发生加成反应
C.萘分子中所有原子在同一平面内 D.一溴代萘(C10H7Br)只有两种同分异构体
(4)现代化学认为萘分子碳碳之间的键是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中可以证明反应H2(g)+I2(g)![]() 2HI(g)已达平衡状态的是
2HI(g)已达平衡状态的是
①单位时间内生成nmol H2的同时生成nmol HI;②一个H-H键断裂的同时有两个H-I键断裂;③百分含量w(HI)=w(I2);④反应速率v(H2)=v(I2)=v(HI);⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1;⑥温度和体积一定时,生成物浓度不再变化;⑦温度和体积一定时,容器内的压强不再变化;⑧条件一定时,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化
A.①②③④B.②⑥⑨C.②⑥⑨⑩D.③⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新能源汽车的大力推广,带动锂电池材料的发展。我国科学家研发出利用钛铁矿(主要成分为![]() ,还含有少量
,还含有少量![]() 、
、![]() 、
、![]() 等杂质)制备锂离子电极材料—
等杂质)制备锂离子电极材料—![]() 和
和![]() 的工艺流程如下:
的工艺流程如下:
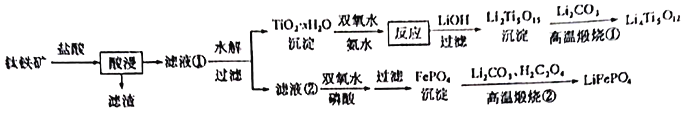
回答下列问题:
(1)![]() 中,Fe元素的化合价为____________。
中,Fe元素的化合价为____________。
(2)“酸浸”后,钛主要以![]() 形式存在,写出
形式存在,写出![]() 水解的的离子方程式_________________。
水解的的离子方程式_________________。
(3)![]() 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
分析高于40℃时![]() 转化率下降的原因_______________。
转化率下降的原因_______________。
(4)![]() 中Ti的化合价为
中Ti的化合价为![]() ,其中过氧键的数目为_____________。
,其中过氧键的数目为_____________。
(5)滤液②中加入双氧水和磷酸,反应生成![]() 的离子方程式为____________;若测得Fe3+沉淀完全后,溶液中
的离子方程式为____________;若测得Fe3+沉淀完全后,溶液中![]() 为
为![]() ,则常温下溶液的pH=______________。(已知
,则常温下溶液的pH=______________。(已知![]() 的
的![]() )
)
(6)从滤液②中得到![]() 沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法_________________________________________。
沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com