
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的一种制取Cu2O的电解池示意图如下,电池总反应为2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1mol Cu2O生成
【答案】A
【解析】
根据电池总反应2Cu+H2O![]() Cu2O+H2↑可知,Cu化合价升高,失去电子,做阳极,发生氧化反应,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O,石墨电极为阴极,H+在阴极得到电子,电极反应式为:2H++2e-=H2↑,据此可分析解答问题。
Cu2O+H2↑可知,Cu化合价升高,失去电子,做阳极,发生氧化反应,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O,石墨电极为阴极,H+在阴极得到电子,电极反应式为:2H++2e-=H2↑,据此可分析解答问题。
A.根据上述分析,石墨作阴极,H+在阴极得到电子,电极反应式为:2H++2e-=H2↑,A选项正确;
B.根据电池总反应2Cu+H2O![]() Cu2O+H2↑可知,Cu化合价升高,失去电子,做阳极,发生氧化反应,B选项错误;
Cu2O+H2↑可知,Cu化合价升高,失去电子,做阳极,发生氧化反应,B选项错误;
C.铜电极为阳极,阳极接电源正极,C选项错误;
D.根据2Cu-2e-+2OH-=Cu2O+H2O,当有0.1mol电子转移时,有0.05mol Cu2O生成,D选项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】如图Ⅰ~Ⅳ所示,下列有关说法正确的是( )
A.实验Ⅰ可以根据澄清石灰水是否变浑浊鉴别碳酸钠和碳酸氢钠固体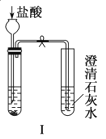
B.实验Ⅱ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠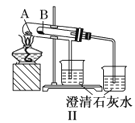
C.与实验Ⅲ相比,实验Ⅱ的优点是可以用一套装置同时进行两个对比实验,而Ⅲ不行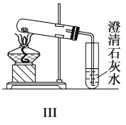
D.实验Ⅳ分别测定等浓度碳酸钠和碳酸氢钠溶液的pH,碳酸氢钠溶液pH大于碳酸钠溶液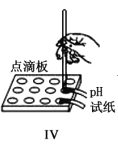
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溴水中加入足量的乙醛溶液,可以看到溴水褪色,对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应;②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸。为探究哪种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性;
方案二:测定反应前溴水中 Br2 的物质的量和反应后溶液中 Br—离子的物质的量。
(1)方案一是否可行__________填(“是”或“否”),理由是____________________。
(2)假设测得反应前溴水中 Br2 的物质的量为 amol,
若测得反应后 n(Br-)=__________mol,则说明溴水与乙醛发生取代反应;
若测得反应后 n(Br-)=__________mol,则说明溴水与乙醛发生加成反应;
若测得反应后 n(Br-)=__________mol,则说明溴水将乙醛氧化为乙酸。
(3)按物质的量之比为 1︰5 配制 1000mLKBrO3-KBr 溶液,该溶液在酸性条件下完全反应可生成 0.5molBr2。取该溶液 10mL 加入足量乙醛溶液,使其褪色,然后将所得溶液稀释为 100mL,准确量取其中 10mL,加入过量的 AgNO3 溶液,过滤、洗涤、干燥后称量得到固体 0.188g。若已知 CH3COOAg 易溶于水,试通过计算判断溴水与乙醛发生反应的类型为__________(选填猜想序号)。
(4)写出上述测定过程中的三个反应的离子方程式:
①KBrO3 和KBr 在酸性条件下的反应:______________________________;
②溴水与乙醛的反应:______________________________;
③测定 Br-离子含量的反应:______________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四幅图示所表示的信息与对应的叙述相符的是( )

A. 图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol—1
B. 图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C. 图3表示一定条件下H2和Cl2生成HCl的反应热与途径无关,则 △H1=△H2+△H3
D. 图4表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工等行业,其难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺流程如图所示:

下列说法正确的是
A.步骤①,为加快海绵铜的溶解速度,可将其进行适当粉碎并用大火持续加热
B.步骤③主要离子方程式:H2O+2Cu2++SO32-+2Cl-=CuCl↓+SO42-+2H+
C.步骤⑤包括用pH=2的酸洗、水洗两步操作,为了防止CuCl被氧化,故不采用硝酸,而应采用硫酸或盐酸
D.步骤⑥中醇洗主要目的是去除CuCl表面水分,但在步骤⑦中仍需要烘干,故节约成本可删除醇洗操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为纪念迪米特里·门捷列夫发明的元素周期表诞生150周年,联合国大会宣布2019年是“国际化学元素周期表年”.元素周期表是科学界最重要的成就之一,表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.
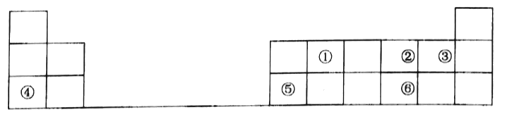
请按要求回答下列问题:
(1)将①、②和③三种元素相比较,非金属性最强的是(填元素符号)______;用原子结构解释原因,理由是:_________
(2)元素②与⑥的氢化物的稳定性顺序为________(填化学式);
(3)元素②与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与①的最高价氧化物反应的化学方程式为__________
(4)元素④和元素⑤的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com