


科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳可以置换出硅 | 碳的非金属性比硅强 | Ⅰ对,Ⅱ对,有 |
| B | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2可做供氧剂 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 工业制取钠用电解法 | Ⅰ对,Ⅱ对,无 |
| D | 硫酸工业中使用了浓硫酸来吸收SO3 | SO3和水反应放出大量的热,产生大量酸雾,阻碍了SO3的吸收 | Ⅰ对,Ⅱ对,有 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、若碳的燃烧热用△H3来表示,则△H3<△H1 |
| B、若碳的燃烧热用△H3来表示,则△H3>△H1 |
| C、稀硫酸与稀NaOH溶液反应的中和热△H=-57.3kJ/mol |
| D、浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 完成以下三个小题
完成以下三个小题查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
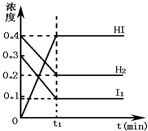 可逆反应H2(g)+I2(g)?2HI(g)在一定的条件下反应混合物中各组分的浓度(mol?L-1)与时间t(min)的变化曲线如图所示,根据图示,回答:
可逆反应H2(g)+I2(g)?2HI(g)在一定的条件下反应混合物中各组分的浓度(mol?L-1)与时间t(min)的变化曲线如图所示,根据图示,回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com