
| A、将2mol金属Cu与含2molH2SO4的浓硫酸共热 |
| B、将1 mol MnO2固体与含4molHCl的浓盐酸共热 |
| C、常温下,将32.2g金属钠和5.4g金属铝同时投入到足量水中 |
| D、常温下,将10.8g的Al和22.4g的Fe投入到300g 98%的硫酸中 |
| ||
| ||
| m |
| M |
| 32.2g |
| 23g/mol |
| 5.4g |
| 27g/mol |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、还原剂是H3AsO3 |
| B、还原性:As>SnCl2 |
| C、M为H2O,是氧化产物 |
| D、每生成7.5 g As,还原剂失去的电子为0.3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡中加入稀硫酸:Ba2++OH-+SO42-+H+=BaSO4↓+H2O |
| B、氧化铜溶于稀硫酸:2H++CuO=Cu2++H2O |
| C、碳酸钙溶于盐酸:CO32-+2H+=CO2↑+H2O |
| D、澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
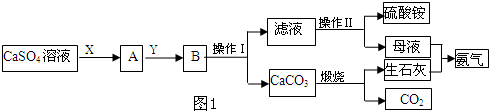
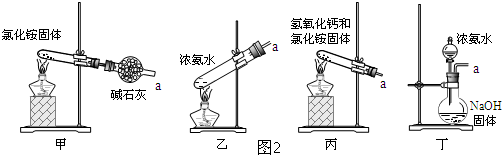
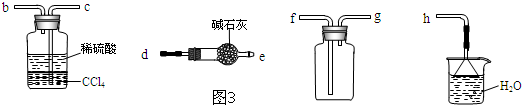
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
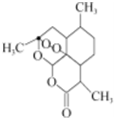 被誉为中国“新四大发明”之一的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.其主要成分是青蒿素(一种从青蒿中分离得到的具有新型化学结构的抗疟药),其结构简式如下图所示.下列有关该有机物的叙述正确的是( )
被誉为中国“新四大发明”之一的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.其主要成分是青蒿素(一种从青蒿中分离得到的具有新型化学结构的抗疟药),其结构简式如下图所示.下列有关该有机物的叙述正确的是( )| A、该有机物的分子式为C14H23O5 |
| B、该有机物不能与NaOH溶液反应 |
| C、该有机物分子中含有过氧键,一定条件下具有氧化性 |
| D、该有机物易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
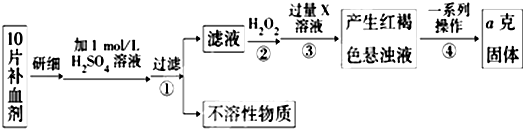
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com