
分析 ①CuO与HCl溶液反应生成氯化铜和水;
②CuSO4溶液与Ba(OH)2溶液反应生成硫酸钡和氢氧化铜沉淀;
③NaHCO3溶液与HCl溶液反应生成氯化钠、二氧化碳和水.
解答 解:①CuO与HCl溶液反应生成氯化铜和水,离子方程式:CuO+2H+=Cu2++H2O;
故答案为:CuO+2H+=Cu2++H2O;
②CuSO4溶液与Ba(OH)2溶液反应生成硫酸钡和氢氧化铜沉淀,离子方程式:Cu2++Ba2++SO42-+OH--=Ba SO4↓+Cu(OH)2↓;
故答案为:Cu2++Ba2++SO42-+OH--=Ba SO4↓+Cu(OH)2↓;
③NaHCO3溶液与HCl溶液反应生成氯化钠、二氧化碳和水,离子方程式:HCO3-+H+=H2O+CO2↑;
故答案为:HCO3-+H+=H2O+CO2↑.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,题目难度不大,注意离子反应遵循客观事实、遵循电荷、原子个数守恒规律.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
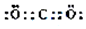 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
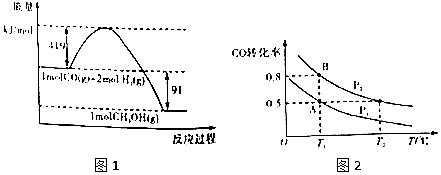
| 化学键 | H-H | H-O | O=O |
| 键能kj/mol | 436 | x | 496 |
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
| 平衡时容器体积 | V(甲) | V(乙) | V(丙) |
| 反应的平衡常数K | K(甲) | K(乙) | K(丙) |
| 平衡时CH3OH的浓度/mol•L-1 | C(甲) | C(乙) | C(丙) |
| 平衡时CH3OH的反应速率/mol•L-1•min-1 | v(甲) | v(乙) | v(丙) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | 仅② | C. | ②④⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取35.20g NaOH | |
| B. | 用10mL量筒量取8.50mL浓盐酸配一定物质的量浓度溶液 | |
| C. | 用25ml滴定管量取15.80ml浓溶液配一定物质的量浓度溶液 | |
| D. | 用pH试纸测得溶液pH为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用粗盐代替NaCl固体 | |
| B. | 定容时,溶液液面低于容量瓶刻度线 | |
| C. | 从烧杯向容量瓶转移溶液时,有少量溶液溅出 | |
| D. | 向容量瓶转移溶液时,容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2+2HCl═MgCl2+2H2O | B. | 2NaOH+H2SO4═Na2SO4+2H2O | ||
| C. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中电能转化为化学能 | |
| B. | 反应低温可以自发转化 | |
| C. | 上述反应若使用催化剂,能改变反应的△H | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=74.8kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com