
| A. | 某沿海城市技术开发公司研制的海水淡化膜--资源问题 | |
| B. | 用石灰法进行工业废气脱硫--污染问题 | |
| C. | 研制用纯净的二氧化硅做光导纤维--能源问题 | |
| D. | 中科院研制的新型钛合金用于航空航天--材料问题 |
分析 A.开发海水淡化膜是为了取得淡水资源;
B.废气中的硫为二氧化硫,为大气污染物;
C.能源就是向自然界提供能量转化的物质,二氧化硅做光导纤维属于材料问题;
D.新型钛合金是一种新型材料.
解答 解:A.开发的海水淡化膜是为了解决淡水资源缺乏,属于资源问题,故A正确;
B.废气中的硫为二氧化硫,2SO2+O2$\frac{\underline{\;飘尘\;}}{\;}$2SO3;SO3+H2O═H2SO4,为形成硫酸型酸雨的主要成分,用石灰法进行工业废气脱硫,属于污染治理问题,故B正确;
C.研制用纯净的二氧化硅做光导纤维,是为了解决光导纤维使用材料问题,不是能源问题,故C错误;
D.新型钛合金是一种材料,中科院研发的新型钛合金属于新材料问题,故D正确.
故选C.
点评 本题考查化学技术的应用,注意了解化学研究的领域或内容,以及化学发展的前景和前沿科技,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 取代,4 mol Cl2 | B. | 加成、取代,3 mol Cl2 | ||
| C. | 加成,2 mol Cl2 | D. | 加成、取代,5 mol Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| D. | 用液溴和苯在催化剂作用下制溴苯: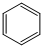 +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的质量分数为w=$\frac{a}{Vρ-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ mol•L-1 | |
| C. | 上述溶液中再加入相同质量的水后,所得溶液的物质的量浓度变为原来一半 | |
| D. | 上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(2n-4m)}{V}mol•{L}^{-1}$ | B. | $\frac{(n-m)}{V}mol•{L}^{-1}$ | C. | $\frac{(2n-2m)}{V}mol•{L}^{-1}$ | D. | $\frac{(5n-10m)}{V}mol•{L}^{-1}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳纳米管和C60都是单质 | |
| B. | 碳纳米管和金刚石的结构和性质相同 | |
| C. | 碳纳米管和石墨互为同素异形体 | |
| D. | 碳纳米管也能在空气中燃烧生成二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| … | E | A | B | ||
| C | … | D |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com