
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性键;含有离子键的化合物属于离子化合物,只含有共价键的化合物属于共价化合物,以此解答该题.
解答 解:氯化氢分子是由氢原子和氯原子构成的,所以氯化氢中只含极性键,
氯气是非金属单质,所以只由非极性键构成的物质是氯气,
氯化铵是由铵根离子和氯离子构成的,属于离子化合物,且是只由非金属元素组成的离子化合物,
过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在非极性共价键,所以由离子键和非极性键构成的物质是过氧化钠,
双氧水中氢原子和氧原子之间存在极性共价键,氧原子和氧原子之间存在非极性共价键,所以由极性键和非极性键构成的物质是双氧水,
故答案为:④;⑦;⑥;②;⑤.
点评 本题考查了离子键、极性共价键、非极性共价键,离子化合物和共价化合物的判断,为高频考点,侧重于基本概念的理解和运用的考查,根据概念来分析解答即可,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 通入酸性高锰酸钾溶液中红色褪去 | |
| B. | 通入品红溶液中红色褪去 | |
| C. | 通入溴水中橙黄色褪去 | |
| D. | 通入氢氧化钠的酚酞溶液中红色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | 只有②④ | C. | ②④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
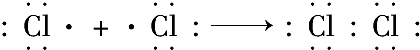 含有非极性键
含有非极性键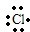 →
→ 含有极性键键
含有极性键键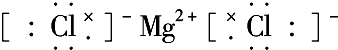 含有离子键
含有离子键 含有极性键、非极性键
含有极性键、非极性键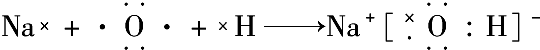 含有离子键、极性键.
含有离子键、极性键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.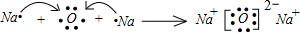 .
. ,该化合物中含有离子键、共价键键(填键的类型).
,该化合物中含有离子键、共价键键(填键的类型).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
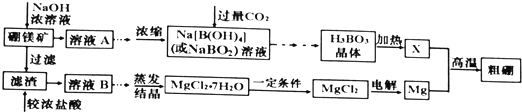
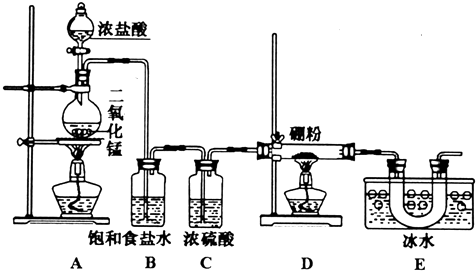
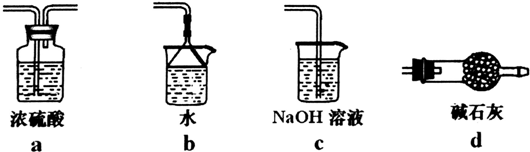
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24Cr的电子排布式:1s22s22p63s23p63d54s1 | |
| B. | K的价电子排布式:4s1 | |
| C. | 氮原子的轨道表示式: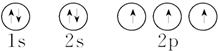 | |
| D. | 硫原子的轨道表示式: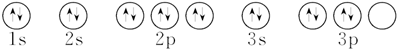 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
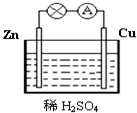 图为原电池的示意图.请回答:
图为原电池的示意图.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com