
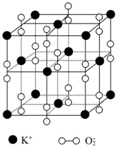
 如图所示是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元).晶体中氧的化合价可看作是部分为0价,部分为-2价.
如图所示是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元).晶体中氧的化合价可看作是部分为0价,部分为-2价.分析 ①根据晶胞图的结构可知,每个钾离子周围有6个O2-离子,每个O2-周围有6个钾离子,据此答题;
②根据均摊法可知,每个晶胞中含有钾离子的个数为8×$\frac{1}{8}$+$6×\frac{1}{2}$=4,含有O2-离子的个数为12×$\frac{1}{4}+1$=4,据此确定化学式;
③A.以顶点上的K+为例,晶体中与每个K+距离最近的K+有分布在经过这个顶点的12个面的面心上,据此判断;
B.根据晶胞图可知,晶体中每个K+周围有6个O2-,每个O2-周围有6个K+,据此判断;
C.以体心上O2-的为例,O2-周围最近且等距离的K+分布在周围6个面的面心上,所以6个K+围成的空间构型为正八面体,据此判断.
解答 解:①根据晶胞图的结构可知,每个钾离子周围有6个O2-离子,每个O2-周围有6个钾离子,所以晶胞结构与氯化钠相似,故选A;
②根据均摊法可知,每个晶胞中含有钾离子的个数为8×$\frac{1}{8}$+$6×\frac{1}{2}$=4,含有O2-离子的个数为12×$\frac{1}{4}+1$=4,所以晶胞中钾离子与O2-的个数比为1:1,所以化学式为KO2,故选D;
③A.以顶点上的K+为例,晶体中与每个K+距离最近的K+有分布在经过这个顶点的12个面的面心上,所以晶体中与每个K+距离最近的K+有12个,故A错误;
B.根据晶胞图可知,晶体中每个K+周围有6个O2-,每个O2-周围有6个K+,故B错误;
C.以体心上O2-的为例,O2-周围最近且等距离的K+分布在周围6个面的面心上,所以6个K+围成的空间构型为正八面体,故C正确,
故选C.
点评 本题是对物质结构的考查,涉及晶胞结构、均摊法的计算等,侧重考查晶胞问题,需要学生具有一定观察与空间想象能力,掌握晶胞中利用均摊法的有关计算,注意识记中学常见晶胞结构,难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 原混合物中CuO与Fe2O3物质的量的比为1:2 | |
| B. | 原混合物中CuO与Fe2O3的质量比为2:1 | |
| C. | 吸收CO2后的溶液中一定有Ba(HCO3)2 | |
| D. | 反应中生成的CO2体积为1.792L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
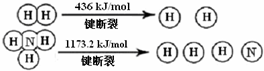
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
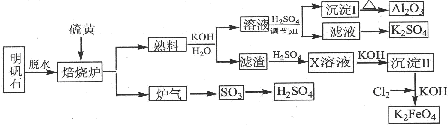
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
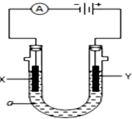
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | H2SO4 | C. | Na2CO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
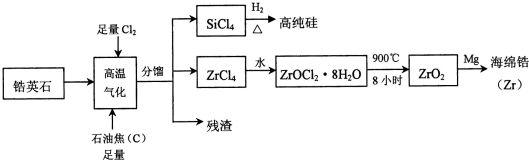
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
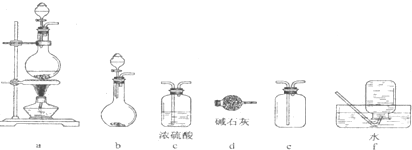
| A. | 加热浓硫酸和乙醇的混合物至170℃制备收集C2H4:连接a→d→f | |
| B. | 制备收集NO2:连接a→c→f | |
| C. | 制备收集Cl2:连接a→d→e | |
| D. | 制备收集NH3:连接b→d→e |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com