
�����Ȼ�ѧ����ʽ��д��ȷ���ǣ�������
| �� | A�� | 2SO2+O2 |
| �� | B�� | C��s��+O2��g���TCO2��g����H=+393.5 kJ/mol |
| �� | C�� | 500�桢30MPa�£���0.5mol N2��1.5 mol H2�����ܱյ������г�ַ�Ӧ����NH3��g��������19.3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g�� |
| �� | D�� | 2.00gC2H2������ȫȼ������Һ̬ˮ�Ͷ�����̼���壬�ų�99.6kJ���������÷�Ӧ���Ȼ�ѧ����ʽΪ��2C2H2��g��+5O2��g���T4CO2��g��+2H2O��l����H=��2589.6kJ/moL |
| �Ȼ�ѧ����ʽ��. | |
| ר�⣺ | ��ѧ��Ӧ�е������仯�� |
| ������ | A����д�Ȼ�ѧ����ʽʱ������Ҫд����Ӧ�ȵķ��ź���ֵ����Ҫע�������ʵľۼ�״̬�� B��C��s��+O2��g���TCO2��g����H��0�� C�����淴Ӧ���ܽ��е��ף�����19.3kJ��N2�� H2û��������ȫ�����ܸ���������ݼ��㣻 D��д���˷�Ӧ�ȵķ��ź���ֵ��ע�������ʵľۼ�״̬�� |
| ��� | �⣺A����д�Ȼ�ѧ����ʽʱ������Ҫд����Ӧ�ȵķ��ź���ֵ����Ҫע�������ʵľۼ�״̬��������û��ע�������ʵľۼ�״̬����A���� B��C��s��+O2��g���TCO2��g�����ڷ��ȷ�Ӧ��C��s��+O2��g���TCO2��g����H=��393.5 kJ/mol����B���� C��0.5mol N2��1.5 mol H2�����ܱյ������г�ַ�Ӧ����NH3��g��������19.3kJ��û����ȫ��Ӧ����C���� D��2C2H2��g��+5O2��g���T4CO2��g��+2H2O��l����H=��2589.6kJ/moLд���˷�Ӧ�ȵķ��ź���ֵ��ע�������ʵľۼ�״̬����D��ȷ�� ��ѡ��D�� |
| ������ | ���⿼�����Ȼ�ѧ����ʽ����д������ע�����⣬��ע���ʵľۼ�״̬�ͷ�Ӧ���ʱ�����д����Ҫ��ע���Ȼ�ѧ����ʽ��д������ԭ����Ŀ�Ѷ��еȣ� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����
A. ��������ϩ��Ϊͬϵ�� B. 32S��33S��ͬ�ֺ���
C. ���������춡�黥Ϊͬ�������� D. �Ҵ��Ͷ����ѣ�CH3-O-CH3����Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ����ᡢ����������أ�����˵����ȷ���ǣ�������
�� A�� ���ײ���ֱ��һ���ڼ�������ʮ���ף�1nm=10﹣9m��֮�䣬������ײ������ڽ���
�� B�� ��ͭ���ҹ�ʹ������ĺϽ�
�� C�� SiO2�ƳɵIJ�����ά�����ڵ�������ǿ������������ͨѶ����
�� D�� ������Ư�۶���ˮ����ҩƷ��ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ס��ҡ�������4�����ʷֱ�2�ֻ�3��Ԫ�أ����ǵķ����и���18�����ӣ�������̬�⻯���ˮ�зֲ���������������ӣ������ƶϺ������ǣ�������
| �� | A�� | ij������Һ��������������ӣ������Һ�Լ��ԣ�ֻ�����ᷴӦ |
| �� | B�� | ����������Ħ��������ͬ������һ�����м��Լ��ͷǼ��Լ� |
| �� | C�� | ���к��ж�����IVA���Ԫ�أ����һ���Ǽ����ͬϵ�� |
| �� | D�� | ���ͼ��и�Ԫ����������ͬ������һ������﹣1�۵�Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Դ�뻷������Խ��Խ�����ǹ�ע��̼һ��ѧ��Ϊ�о����ȵ㣮��̼һ��ѧ�����Ե���̼��CO��CO2��CH4��CH3OH�Ⱥ�һ��̼ԭ�ӵ�����Ϊԭ�Ϻϳɹ�ҵ��Ʒ�Ļ�ѧ�빤�գ�
���Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g��⇌CH3OH��g��+H2O��g����H=﹣49.0kJ/mol�����¶Ⱥ��ݻ���ͬ��A��B��C���������У����������Ϊ2L��������ͬ��ʽͶ�뷴Ӧ����ֺ��º��ݣ���10���Ӻ�ﵽƽ�⣬�ﵽƽ��ʱ���й��������±���
| ���� | A | B | C |
| ��Ӧ��Ͷ���� | 1molCO2��g���� 3molH2��g�� | 1molCH3OH��g���� 1molH2O��g�� | 2molCO2��g����6mol H2��g�� |
| CH3OH��g��Ũ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�����仯 | �ų�29.4kJ | ����a kJ | �ų�b kJ |
�ٴӷ�Ӧ��ʼ����ƽ��ʱ��A����CO2����ʾ��ƽ����Ӧ����Ϊ��0.03��mol/��L•s�����þ�����ֵ��ʾ��
��a=��19.6����c1��=��c2������1/2c3���������������=������
��CO�����ںϳɼ״�����ѹǿ0.1MPa�����£������ΪbL���ܱ������г���amolCO��2amolH2���ڴ��������ºϳɼ״���CO��g��+2H2��g��⇌CH3OH��g����ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ1��ʾ

��1���÷�Ӧ���ڷ�Ӧ�����ȡ�������ȡ����ȡ�����P2������0.1MPa���������������=����
��2��100��ʱ���÷�Ӧ��ƽ�ⳣ��K=��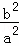 �����ú�a��b�Ĵ���ʽ��ʾ��
�����ú�a��b�Ĵ���ʽ��ʾ��
��̼һ����������������β������Ҳ���п�Ϊ����CO��CH4����һ�������¾������뵪��������������Ⱦ�����ʣ�CO��NO�ڴ����������·�Ӧ���£�2NO��g��+2CO��g��⇌2CO2��g��+N2��g����H��0���ھ��ȡ����ݵ��ܱ������м���һ������NO��CO����������Ӧ��ͼ2��ʾ��ͼ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬���ǡ�c��������ĸ��ţ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
þ��ض��Ե͡���ȾС����ѹ�߶�ƽ�ȣ�����Ϊ����������ɫ��صĹ�ע���㣮����һ��þ��صķ�Ӧԭ��Ϊ��xMg+Mo3S4 Mg2Mo3S4������˵������ȷ���ǣ�������
Mg2Mo3S4������˵������ȷ���ǣ�������
| �� | A�� | �ŵ�ʱ��Mo3S4����������Ӧ |
| �� | B�� | �ŵ�ʱ��������Ӧʽ��Mo3S4+2xe����Mo3S42x�� |
| �� | C�� | ���ʱ��Mg2+������Ǩ�� |
| �� | D�� | ���ʱ��������Ӧʽ��xMg2++2xe����xMg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������鶼����Ҫ���⻯���Ҫ��ش��������⣺
��1��NH3��g����O2��g����Ӧ����NO��g����H2O��g���ġ�H��������ֱ�Ӳ������Ӳ����ȶ��Կ�������Ҫԭ����������
��֪��1molN2��g����Ӧ����2mol NH3��g���ġ�H=��92kJ•mol��1��1mol H2��g��ȼ������H2O ��g�� �ġ�H=��242kJ•mol��1��1mol N2��g����O2 ��g����ȫ��Ӧ����NO��g���ġ�H=+180kJ•mol��1������17g ��������������ȫ����һ�����������ˮ�������ų�������Ϊ������
��2��������ˮ����ͨ��۽�̫���ܷ�Ӧ�����ɷ�����Ӧ�Ļ�ѧ����ʽΪCH4+H2O⇌CO+3H2���÷�ӦΪ���ȷ�Ӧ����֪�����ֲ�ͬ���������£������IJ�����ʱ��ı仯��ͼ1��ʾ��
����0��20Сʱ�ڣ�����ķ�Ӧ����v����v����v���Ӵ�С��˳��Ϊ������
�ڽ�0.4mol�����0.4molˮ��������2L���ݵ��ܱ������У�ij�����·�Ӧ�ﵽƽ�⣬������������ʵ���Ũ��Ϊ0.3mol•L��1����������´˷�Ӧ��ƽ�ⳣ��K=�����������ת����Ϊ������
�������İٷֺ�������ϵ��ѹǿ��P�����¶ȣ�T���Ĺ�ϵ��ͼ2��ʾ��
ƽ��״̬��A�䵽Bʱ����Ӧ��ƽ�ⳣ����K��A������K��B�������������������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
±�ص��ʼ������������������϶������ŵݱ���ɣ������й�˵����ȷ���ǣ�������
| �� | A�� | ±��������ɫ��AgCl��AgBr��AgI ��˳�����μ��� |
| �� | B�� | ±����ļ�����H��F��H��C1��H��Br��H��I��˳�����μ�С |
| �� | C�� | ±����Ļ�ԭ��HF��HCl��HBr��HI��˳�����μ��� |
| �� | D�� | ±�ص������������ϰ�F2��Cl2��Br2��I2��˳�����ѱ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ϩͪ��CH2��C��O����һ�����������뺬������Ļ�������ӳɷ�Ӧ����Ӧ�ɱ�ʾΪ��CH2��C��O��HA��CH3��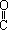 A����ϩͪ��һ�������¿��������Լ��ӳɣ�����ﲻ��ȷ����( )
A����ϩͪ��һ�������¿��������Լ��ӳɣ�����ﲻ��ȷ����( )
A ��HCl�ӳ�����CH3COCl
B ��H2O�ӳ�����CH3COOH
C ��CH3OH�ӳ�����CH3COCH2OH
D ��CH3COOH�ӳ�����CH3��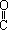 ��O��
��O��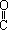 ��CH3
��CH3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com