
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数必为0.5NA
C. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
D. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
【答案】C
【解析】
A、0.2molFe在高温下与水蒸气反应生成四氧化三铁,生成氢气的物质的量是0.8/3mol,A错误;
B. 粗铜中含有铁 锌等杂质,铁、锌先于铜失电子,所以电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数定小于0.5NA,B错误;
C. 5NH4NO3=2HNO3+4N2↑+9H2O反应中,28g氮气的物质的量是1mol,其中-3价N元素全部被氧化,被氧化的N原子的物质的量占生成氮气N原子物质的量是5/8,所以转移电子数目是1mol×2×5/8×3×NA=3.75NA,C正确;
D. 氢氧燃料电池正极为氧气发生还原反应,消耗22.4L(标准状况)氧气时,电路中通过的电子数目为22.4L/22.4L/mol×4×NA=4NA,D错误;
正确选项C。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关有机物的描述不正确的是
A. 有机物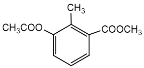 的核磁共振氢谱图中有4种类型的氢原子吸收峰
的核磁共振氢谱图中有4种类型的氢原子吸收峰
B. 用FeCl3溶液可以鉴别苯、苯酚、四氯化碳、KSCN、乙醇和AgNO3六种无色溶液或液体
C. 有机反应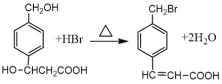 涉及取代反应和消去反应两种类型
涉及取代反应和消去反应两种类型
D. 1 mol 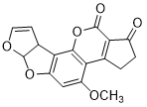 一定条件下最多可以与6 mol H2反应
一定条件下最多可以与6 mol H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列7种化学符号:![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]()
(1)表示核素的符号共______种。
(2)互为同位素的是______和______。
(3)质量数相等,但不能互为同位素的是______和______。
(4)中子数相等,但质子数不相等的是______和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CaO+SO2 = CaSO3 ,2CaSO3 + O2 = 2CaSO4 。为了真正减轻煤燃烧产生的污染,你认为下列措施可取的是( )
A.尽量用大块状的燃煤B.通入过量的空气
C.煤粉中掺进适量的生石灰D.高烟囱降低污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)基态亚铜离子价电子排布式为____________;第一电离能I(Cu)________I (Zn)(填“>”或“<”)原因__________________________________________;
(2)Cu(CH3CN)42+比四氨合铜离子还稳定,配离子中Cu的配位数是_______,配体中碳原子的杂化类型是_________________,1molCH3CN中σ键的个数为_____________;
(3)CuCl是有机合成中常见催化剂。CuCl熔化后几乎不导电,推测CuCl晶体中化学键类型为_________;CuCl加强热会分解生成铜,铜晶体的堆积方式为__________(用文字表示)。
(4)冰晶体的结构与金刚石的结构相似,属立方晶系。如图,将金刚石晶胞中的C原子全部置换成O原子,O原子与最近距离的四个O原子相连,H原子插入两个相连的O原子之间,与氧形成一个共价键和一个氢键,即为冰中的共价键和氢键。0℃时冰晶体中氢键的键长(A—H…B)为_______________pm(列式并计算)。(0℃时冰密度为0.9g˙cm-3)![]()
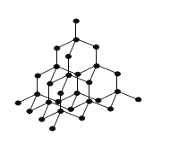
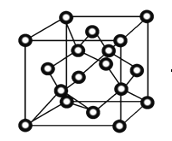
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的试剂或方法不正确的是
A. Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B. NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C. Na2O2粉末(Na2O),将混合物在氧气中加热
D. Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关材料的叙述中,错误的是
A. 合金具有许多优良的物理、化学或机械性能
B. 硅单质是光导纤维的主要成分
C. 硅酸盐产品有陶瓷、玻璃、水泥等
D. 普通玻璃是以纯碱、石灰石和石英为原料制成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)下列纯净物中:a.NaOH b.Ar c.MgCl2 d.HCl e.NH3 f.KNO3
①不含化学键的物质是_______(填序号,下同)。
②既含有离子键又含有共价键的物质是______。
③只含有离子键的物质是________。
(2)下列变化中,不需要破坏化学键的是______。
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠溶于水
(3)实验室盛放碱液的试剂瓶不能用玻璃塞,以氢氧化钠为例,用离子方程式表示其原因:_________,任写一个制造普通玻璃的主要反应的化学方程___________________。
(4)硅是良好的半导体材料,写出工业上生产粗硅的化学方程式:__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com