
【题目】柔性电子产品因具有独特的柔性、延展性等优点在信息、医疗、能源等领域具有广泛应用前景。下图为中科院张新波课题组受中国传统书法艺术启发,直接将用毛笔书写后的纸张和锂箔作为电极材料组装成的锂空气电池。下列说法不正确的是( )

A. 纸张电极是该电池的正极
B. 锂箔电极发生的电极反应:Li﹣e-=Li+
C. 电池工作时,电子从锂箔电极经导线流向纸张电极,再从纸张电极经电解质溶液流向锂箔电极
D. 该电池具有轻型、柔性且可折叠的特点,有望应用于柔性电子器件
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】请根据氧化还原反应Fe+2H+=Fe2++H2↑设计成原电池:
①负极材料为:发生的电极反应是: ,
电流(填“流出”或“流入”)
②正极发生的电极反应是:
该反应为(填“氧化反应”或“还原反应”)
③若电路中转移6.02×1022个e﹣ , 则产生标况下H2的体积为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)某化学兴趣小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是 ,说明反应放热。(下列装置中支撑及捆绑等仪器已略去)
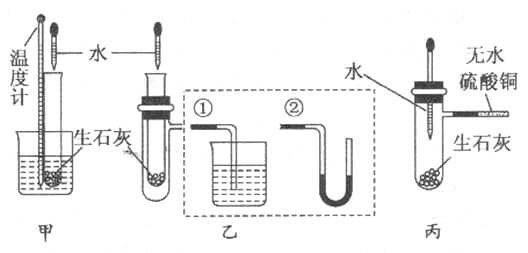
乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是(接①) ,(接②) ,说明反应放热。
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是 ,说明反应放热,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336ml(标准状况)气体。回答下列问题:
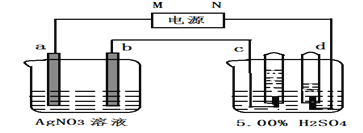
(1)根据图中c、d两极上产生气体的体积判断电源N极为_______极(填“正”或“负),电解池中a为______极。请写出a极的电极反应式:___________________.
(2) AgNO3溶液的浓度________(填“增大”“减小”或“不变”,下同),AgNO3溶液的pH_________,H2SO4溶液的浓度__________,H2SO4溶液的pH________.
(3)上述过程中通过电路的电子______mol.
(4)若H2SO4溶液中溶质的质量分数由5.00%变为5.02%,则原有的5.00%溶液为____g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) △H=-a kJ.mol-1(a>0)。下列说法不正确的是
3Z(g) △H=-a kJ.mol-1(a>0)。下列说法不正确的是
A. 升高反应温度,逆反应速率增大,正反应速率增大
B. 达到化学平衡状态时,X、Y、Z的质量不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达akJ
D. X和Y充分反应生成Z的物质的量不可能达到3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
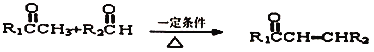
【题目】某研究小组按下列路线合成饮料、香水的增香剂香豆素。
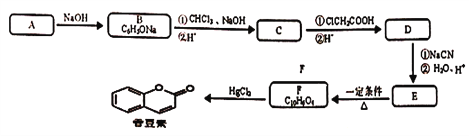
已知:
1. 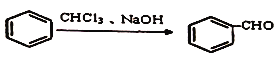
2. 
3. 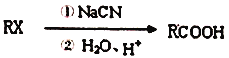
请回答:
(1) C→D的反应类型是________。
(2)下列说法不正确的是________。
A.化合物A的官能团是羧基 B.化合物B的水溶液显碱性
C.化合物D能发生银镜反应 D.香豆素的分子式是C9H8O2
(3)写出E→F的化学反应方程式________。
(4)设计以苯、乙烯为主要原料制备![]() 的合成路线(用流程图表示,无机试剂任选)____。
的合成路线(用流程图表示,无机试剂任选)____。
(5)G为C的同分异构体,并符合下列条件。写出G的结构简式____。
①分子除含有苯环外不含其它环状结构;②lmolG最多能与2molNaOH反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 配制FeCl2溶液时,加入铁粉的原因:Fe+Fe3+=2Fe2+
B. 二氧化锰和浓盐酸反应:MnO2+4HCl(浓)![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
C. “水玻璃”长期暴露在空气中会变质:SiO32-+CO2+H2O=H2SiO3↓+CO32-
D. 向硫酸氢钠溶液中滴加氢氧化钡溶液至中性:H++SO42++Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组采用活性炭回收海带化工提碘废水中残留的低浓度碘(主要以I-形式存在,杂质不参与反应),实验过程如下:
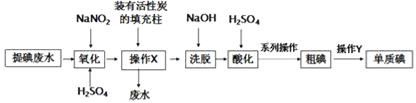
已知:3I2+6NaOH=5NaI+NaIO3+3H2O;
I2+2S2O32-=2I-+S4O62-。
请回答:
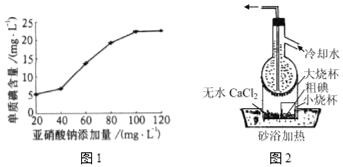
(1)结合图1可知,NaNO2最适宜的添加量为_____mgL-1。
(2)操作X的目的是_____。
(3)系列操作中涉及抽滤操作,下列有关抽滤的说法中不正确的是_____。
A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B.当溶液具有强酸性、强氧化性时,可用玻璃砂漏斗代替布氏漏斗
C.抽滤不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D.洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物
(4)进行操作Y时所用装置如图2所示(省去了夹持装置),则操作Y的名称为_____;该装置中有两处不合理,请指出其中的一处_____。
(5)称取0.5080g粗碘试样于250mL碘量瓶中,加入足量的KI溶液,加盖摇匀至碘完全溶解.迅速用0.1200molL-1Na2S2O3标准溶液滴定至浅黄色,再加入淀粉指示剂,继续滴定至蓝色褪去即为终点,共消耗Na2S2O3标准溶液24.00mL。则粗碘试样中碘单质的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NH3催化还原氮的氧化物,可以消除氮的氧化物的污染。已知:
反应①:4NH3(g)+ 6NO(g)![]() 5N2(g) + 6H2O(l) △H1
5N2(g) + 6H2O(l) △H1
反应②:2NO(g) + O2(g)![]() 2NO2(g) △H2(△H2<0且
2NO2(g) △H2(△H2<0且![]() )
)
反应③:4NH3(g) + 6NO2(g)![]() 5N2(g)+ 3O2 + 6H2O(l) △H3
5N2(g)+ 3O2 + 6H2O(l) △H3
反应①和反应②在不同温度时的平衡常数及其大小关心如下表:
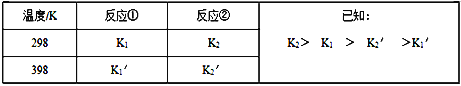
(1)试推测反应③是______ 反应(填“吸热”或“放热”)
(2)相同条件下反应①在2L的密闭容器中选用不同的催化剂,反应产生N2的物质的量随时间的变化如图所示。
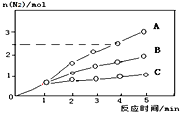
则:
①计算0~4min时在A催化剂作用下,反应速率v(NO)=__________。
②下列说法正确的是:__________________。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B) >Ea(C)
B.增大压强能使反应速率加快的原因,是因为增加活化分子的百分数
C.单位时间内H-O键与N-H断裂的数目相等时,说明反应已达平衡状态
D.若在恒容绝热的密闭容器中进行,当温度不变时,说明反应已达平衡状态
(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO和2 molO2,反应一段时间后,测的生成NO21.6mol,则该反应是否达到平衡状态?_______(填“是”或“不是”。已知该温度下该反应的K约为147.3)。达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和0.9mol的O2,则还要加入NO______mol、O2_____mol,达平衡时各物质的浓度才能跟前平衡的相等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com